题目内容
【题目】一定条件下,在体积为10L的密闭容器中,1 mol X和1 mol Y 进行反应:2X (g) + Y (g) ![]() Z (g),经60s达到平衡,生成0.3 mol Z,下列说法正确的是( )
Z (g),经60s达到平衡,生成0.3 mol Z,下列说法正确的是( )
A. 以 X浓度变化表示的反应速率为0.002 mol/(L·s)
B. 将容器体积变为20 L,Z的平衡浓度为原来的1/ 2
C. 若增大压强, 则物质 Y 的转化率减小
D. 若升高温度, X的体积分数增大, 则该反应的 ΔH < 0
【答案】D
【解析】A. 以Z的浓度变化表示的反应速率为:v(Z)= 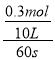 =0.0005 mol/(L·s),根据同一方程式中各物质表示的反应速率之比等于其化学计量数之比,则用X浓度变化表示的反应速率为:0.0005 mol/(L·s)×2 = 0.001mol/(L·s),故A错误;
=0.0005 mol/(L·s),根据同一方程式中各物质表示的反应速率之比等于其化学计量数之比,则用X浓度变化表示的反应速率为:0.0005 mol/(L·s)×2 = 0.001mol/(L·s),故A错误;
B. 将容器体积变为20L,压强减小,平衡逆向移动,则Z的平衡浓度小于原来的1/2,故B错误;
C. 增大压强,平衡正向移动,则物质Y的转化率增大,故C错误;
D. 若升高温度,X的体积分数增大,可知升高温度平衡逆向移动,则正反应为放热反应,所以该反应的△H<0,故D正确;
故答案选D。

练习册系列答案
相关题目