题目内容
【题目】A、B、C、D、E五种短周期元素,0.5molA的元素的离子得到NA个电子后被还原为中性原子;0.4gA的氧化物恰好与100mL0.2mol/L的盐酸完全反应;A元素原子核内质子数与中子数相等。B元素原子核外电子数比A元素原子核外电子数多1;C- 离子核外电子层数比A元素的离子核外电子层数多1;D元素原子最外层电子数是次外层电子数的2倍;E元素的单质是淡黄色固体,其难溶于水,微溶于酒精,易溶于CS2 。
请填写下列空格:
(1) C- 离子的结构示意图__________________;
(2) D元素的最高价氧化物的结构式是_______________;
(3) C、D两元素形成的化合物电子式________,分子内含有______键(填极性或非极性)。
(4)用电子式表示A、C两元素形成的化合物的过程_______________________________。
(5)元素B与E的最高价氧化物的水化物反应的离子方程式_________________________。
(6)以硼酸为原料可制得硼氢化钠(NaBH4),它是有机合成中的重要还原剂,其电子式为____________________。
【答案】 Cl- 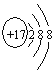 O=C=O
O=C=O 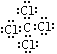 极性
极性 ![]() Al(OH)3+3H+=Al3++3H2O
Al(OH)3+3H+=Al3++3H2O 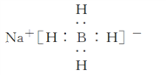
【解析】A、B、C、D、E五种短周期元素,0.5molA的元素的离子得到NA个电子后被还原为中性原子,这说明0.5molA离子得到1个电子转化为单质A,因此A显+2价;0.4gA的氧化物恰好与100mL0.2mol/L的盐酸完全反应,则根据AO+2HCl=ACl2+H2O可知AO的相对分子质量是0.4/(0.1×0.2)=40,因此A的相对原子质量是40-16=24,A元素原子核内质子数与中子数相等,则A的质子数是12,A是Mg。B元素原子核外电子数比A元素原子核外电子数多1,B是Al;C- 离子核外电子层数比A元素的离子核外电子层数多1,则C是Cl;D元素原子最外层电子数是次外层电子数的2倍,D是C;E元素的单质是淡黄色固体,其难溶于水,微溶于酒精,易溶于CS2,所以E是S,则
(1) Cl- 离子的结构示意图为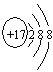 ;(2) D元素的最高价氧化物是CO2,结构式是O=C=O;(3) C、D两元素形成的化合物是CCl4,含有极性键,电子式为
;(2) D元素的最高价氧化物是CO2,结构式是O=C=O;(3) C、D两元素形成的化合物是CCl4,含有极性键,电子式为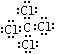 。(4)A、C两元素形成的化合物是氯化镁,形成过程可表示为
。(4)A、C两元素形成的化合物是氯化镁,形成过程可表示为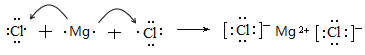 。(5)元素B与E的最高价氧化物的水化物分别是氢氧化铝和硫酸,反应的离子方程式为Al(OH)3+3H+=Al3++3H2O。(6)硼氢化钠(NaBH4)是离子化合物,其电子式为
。(5)元素B与E的最高价氧化物的水化物分别是氢氧化铝和硫酸,反应的离子方程式为Al(OH)3+3H+=Al3++3H2O。(6)硼氢化钠(NaBH4)是离子化合物,其电子式为 。
。

【题目】分类法是一种行之有效、简单易行的科学方法。某同学用如下表所示的形式对所学知识进行分类,其中甲与乙、丙、丁是包含关系。其中正确的组合是
甲 | 乙、丙、丁 | |
① | 常见干燥剂 | 浓硫酸、石灰石、碱石灰 |
② | 常见合金 | 不锈钢、靑铜、生铁 |
③ | 腐蚀品 | 浓硫酸、烧碱、硝酸 |
④ | 碱性氧化物 | 过氧化钠、氧化镁、氧化铁 |
⑤ | 弱电解质 | 醋酸、一水合氨、水 |
A. ①② B. ②③⑤ C. ③④⑤ D. ①④⑤
