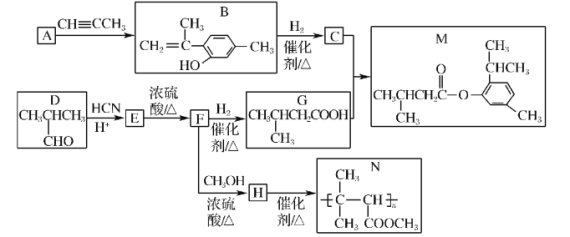
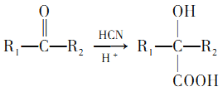
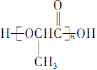��Ŀ����
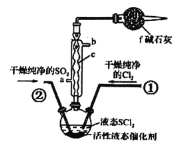
����Ŀ��ij��ѧ��ȤС��������ͼװ����ʵ���ҽ��а��Ĵ�����ʵ�顣
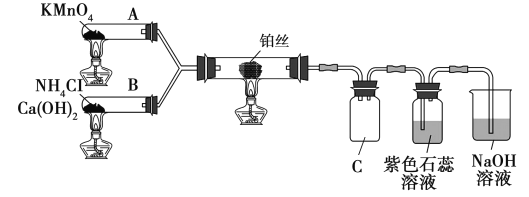
��֪��NO2�ڸ���150��ʱ���ȶ������ֽ��NO��O2
��1�����Ĵ�������Ӧ�Ļ�ѧ����ʽΪ___��
��2�����ƿc�й۲쵽����ɫ���壬����Ϊ___��
��3��ʵ�鷢�֣�ֹͣ����ֱ�����ܺ�ʱ��ֱ����������δ�۲쵽����ɫ���壬˵��ֱ�������з�Ӧ��___��Ӧ(��������������������)��
��4��ֹͣͨO2������ͨNH3�����ƿC�к���ɫ������ȥ�����ִ������̣�������������___��
��5��ʵ���Ҽ���NH3�ķ�����___��
���𰸡�4NH3+5O2![]() 4NO+6H2O ������NO2 ���� NH4NO3(�����) ��ʪ��ĺ�ɫʯ����ֽ���飬��ֽ����֤����NH3
4NO+6H2O ������NO2 ���� NH4NO3(�����) ��ʪ��ĺ�ɫʯ����ֽ���飬��ֽ����֤����NH3
��������
(1) �����ڴ������¿ɱ���������NO��ˮ��
(2) һ������������ƿc�кͿ����е�������Ӧ���ɺ���ɫ�������������
(3) NO2�ڸ����»�ֽ⣬ֹͣ����ֱ�����ܺ�ʱ��ֱ����������δ�۲쵽����ɫ���壬˵���÷�Ӧ�Ƿ��ȷ�Ӧ��
(4)ƿ�ڵ�NO2��ˮ������Ӧ�������ᣬ����ͨNH3�������ٺ����ᷴӦ�����˰�ɫ��NH4NO3���塣
(1) �����ڴ������¿ɱ���������NO��ˮ������ʽΪ��4NH3+5O2![]() 4NO+6H2O���ʴ�Ϊ��4NH3+5O2
4NO+6H2O���ʴ�Ϊ��4NH3+5O2![]() 4NO+6H2O��
4NO+6H2O��
(2) һ������������ƿc�кͿ����е�������Ӧ���ɺ���ɫ��������������ʴ�Ϊ��������NO2��
(3) ����֪������NO2�ڸ���150��ʱ���ȶ������ֽ��NO��O2��ֹͣ����ֱ�����ܺ�ʱ����δ�۲쵽����ɫ���壬˵��ֱ�������з�Ӧ�Ƿ��ȷ�Ӧ����ά���¶�һ��ʱ�䣬�ʴ�Ϊ�����ȣ�
(4) ƿ���а������ɣ�����������ƿ����ˮ�������ڣ�NO2��ˮ������Ӧ�������ᣬ�����ٺ����ᷴӦNH3+HNO3=NH4NO3�������˰�ɫ��NH4NO3���壬�ʴ�Ϊ��NH4NO3(�����)��
(5)ʵ������ʪ��ĺ�ɫʯ����ֽ���鰱�����ʴ�Ϊ����ʪ��ĺ�ɫʯ����ֽ���飬��ֽ����֤����NH3��

 ��Ԫȫ��������ϵ�д�
��Ԫȫ��������ϵ�д� �»ƸԱ����ܾ�ϵ�д�
�»ƸԱ����ܾ�ϵ�д�