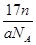题目内容
将8 mL NO2和O2的混合气体通入倒立于水槽中装满水的量筒,充分反应后,剩余气体为1 mL,则原混合气体中NO2和O2的体积比可能为 ( )
| A.7∶5 | B.3∶7 | C.7∶1 | D.1∶7 |
C
试题分析:如果剩余气体是氧气,则根据反应式4NO2+O2+2H2O=4HNO3可知,参加反应的气体一共是7mL,则其中氧气是
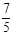 mL,所以氧气一共是2.4mL,因此NO2和O2的体积比为7:3。如果剩余气体是NO,则反应中剩余NO2,剩余的NO2继续和水反应,方程式为3NO+H2O=2HNO3+NO,所以剩余的NO2水3mL,则参加反应的气体是5mL。其中氧气是1mL,因此NO2和O2的体积比为7:1,答案选C。2溶于水的有关计算
mL,所以氧气一共是2.4mL,因此NO2和O2的体积比为7:3。如果剩余气体是NO,则反应中剩余NO2,剩余的NO2继续和水反应,方程式为3NO+H2O=2HNO3+NO,所以剩余的NO2水3mL,则参加反应的气体是5mL。其中氧气是1mL,因此NO2和O2的体积比为7:1,答案选C。2溶于水的有关计算点评:本题的关键是要讨论过量问题,并且最后剩余的气体不可能是NO2。

练习册系列答案
 黄冈课堂作业本系列答案
黄冈课堂作业本系列答案 单元加期末复习先锋大考卷系列答案
单元加期末复习先锋大考卷系列答案
相关题目
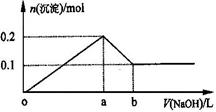


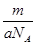 mol
mol