题目内容
(6分)在250mlKI溶液中通入一定量的Cl2,再将所得溶液蒸干,并加热到质量不再减少为止,称得固体质量为23.2g,经实验分析所得固体中含碘27.37%,试计算:
⑴原KI溶液的物质的量浓度是多少?
⑵参加反应的Cl2有多少升(标准状况)?
⑴原KI溶液的物质的量浓度是多少?
⑵参加反应的Cl2有多少升(标准状况)?
⑴原KI溶液的物质的量浓度为1mol/L
⑵参加反应的Cl2为2.24L
⑵参加反应的Cl2为2.24L
试题分析:氯气与碘化钾反应生成碘单质和氯化钾,而加热后碘单质挥发,
故27.37%是碘离子的质量分数,
由此可得碘化钾质量23.2g´27.37%¸127´166=8.3g,所以氯化钾为14.9g,
又由于每166g碘化钾生成74.5g氯化钾,
故所有氯化钾由33.2g碘化钾生成,
即原有碘化钾41.5g即0.25mol,原KI溶液的物质的量浓度为0.25mol¸0.25L=1mol/L。
因为氯化钾14.9g即0.2mol,所以有0.1mol氯气参加反应,即2.24L
点评:熟悉题目涉及的反应。找准相关关系进行计算。

练习册系列答案
相关题目
 MnCl2+Cl2↑+2H2O
MnCl2+Cl2↑+2H2O Na参加氧化还原反应时电子转移NA
Na参加氧化还原反应时电子转移NA 与
与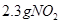 所含有的氧原子数相等
所含有的氧原子数相等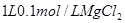 溶液中
溶液中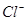 离子数为
离子数为
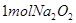 与足量水反应后转移的电子数为2NA
与足量水反应后转移的电子数为2NA