题目内容
为了减少CO对大气的污染,某研究性学习小组拟研究CO和H2O反应转化为绿色能源H2。已知:

2CO(g)+O2(g)=2CO2(g) ΔH =-566 kJ·moL-1
2H2(g)+O2(g)=2H2O(g) ΔH =-483.6 kJ·moL-1
H2O(g)=H2O(l) ΔH =-44.0 kJ·moL-1
(1)氢气的标准燃烧热△H = kJ·moL-1。
(2)写出CO和H2O(g)作用生成CO2和H2的热化学方程式: 。
(3)H2是一种理想的绿色能源,可作燃料电池;若该氢氧燃料电池以KOH为电解质溶液,其负极的电极反应式是 。

2CO(g)+O2(g)=2CO2(g) ΔH =-566 kJ·moL-1
2H2(g)+O2(g)=2H2O(g) ΔH =-483.6 kJ·moL-1
H2O(g)=H2O(l) ΔH =-44.0 kJ·moL-1
(1)氢气的标准燃烧热△H = kJ·moL-1。
(2)写出CO和H2O(g)作用生成CO2和H2的热化学方程式: 。
(3)H2是一种理想的绿色能源,可作燃料电池;若该氢氧燃料电池以KOH为电解质溶液,其负极的电极反应式是 。
(1)-285.8(2)CO(g)+ H2O(g)= CO2(g) + H2(g) ΔH =-41.2 kJ·moL-1(化学式错误、配平错误、△H(含单位)没写或写错、物质的聚集状态没写或写错的均不给分,下同)(3)H2-2e?+2OH- =2H2O
试题分析:(1)已知:①2H2(g)+O2(g)=2H2O(g)△H=-483.6KJ?moL-1;②H2O (g)=H2O(l)△H=-44.0KJ?moL-1;根据盖斯定律,①×1/2+②得H2(g)+1/2O2(g)=H2O(l)△H=1/2×(-483.6KJ?moL-1)+(-44.0KJ?moL-1)=-285.8KJ?moL-1;(2)已知:①2CO(g)+O2(g)=2CO2(g)△H=-566kJ?moL-1;②2H2(g)+O2(g)=2H2O(g)△H=-483.6KJ?moL-1根据盖斯定律,①-②得2CO(g)+2H2O(g)=2H2(g)+2CO2(g)△H=-566kJ?moL-1-(-483.6KJ?moL-1)=-82.4KJ?moL-1;CO(g)+H2O(g)=H2(g)+CO2(g)△H=-41.2KJ?moL-1;原电池负极发生氧化反应,氢气在负极放电,在碱性条件下,氢气放电生成水,负极电极反应式为H2-2e-+2OH-═2H2O。

练习册系列答案
相关题目
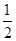 O2(g) ===CO(g);ΔH1 C(s)+O2(g) ===CO2(g);ΔH2
O2(g) ===CO(g);ΔH1 C(s)+O2(g) ===CO2(g);ΔH2 CH3OH(g) ΔH1
CH3OH(g) ΔH1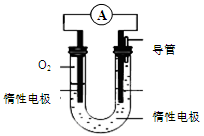
 2SO3(g) △H<0反应,某温度下,SO2的平衡转化率(α)与体系总压强(p)的关系如下图所示,根据图示回答下列问题:
2SO3(g) △H<0反应,某温度下,SO2的平衡转化率(α)与体系总压强(p)的关系如下图所示,根据图示回答下列问题:

 CO2(g)+H2(g),该反应的△H________0(选填:“>”、“<”、“=”);在900K时,该反应平衡常数的对数值(lgK)=_____________.
CO2(g)+H2(g),该反应的△H________0(选填:“>”、“<”、“=”);在900K时,该反应平衡常数的对数值(lgK)=_____________.


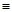 N键吸收941kJ热量,则1molN4气体转化为2molN2时要放出______________ kJ能量。
N键吸收941kJ热量,则1molN4气体转化为2molN2时要放出______________ kJ能量。