题目内容
KClO3与浓盐酸发生如下反应:KClO3+6HCl(浓)=KCl+3Cl2↑+3H2O,有关该反应,说法不正确的是:( )
| A.被氧化的元素和被还原的元素的质量之比5:1 |
| B.Cl2既是氧化产物,又是还原产物 |
| C.盐酸既体现酸性,又体现酸性还原性 |
| D.转移5mol电子时,产生67.2L的Cl2 |
D
解析试题分析:在反应KClO3+6HCl(浓)=KCl+3Cl2↑+3H2O中,KClO3中的Cl得到电子,被还原变为Cl2,每摩尔的Cl得到5mol的电子,HCl中的Cl失去电子,也变为Cl2,每摩尔的Cl失去1mol的电子。A.由于在氧化还原反应中电子得失数目相等。因此被氧化的元素和被还原的元素的质量之比5:1。正确。B.Cl2既是氧化产物,又是还原产物。正确。C.在该反应中6mold HCl促进反应,有1mol的起酸的作用,有5mol的作还原剂。故在该反应中盐酸既体现酸性,又体现酸性还原性。正确。 D.转移5mol电子时,产生3mold的Cl2。在标准状况下其体积为67.2L。却条件,体积大小无意义。错误。
考点:考查氧化还原反应中的电子转移及物质的作用的知识。

 一本好题口算题卡系列答案
一本好题口算题卡系列答案高铁酸钾(K2FeO4)是一种新型、高效、多功能水处理剂,其与水的离子反应是:
4FeO42-+10H2O=4Fe(OH)3(胶体)+3O2↑+8OH-
工业上先制得高铁酸钠,然后在低温下,向高铁酸钠溶液中加入一定量的KOH就可制得高铁酸钾。制备高铁酸钠的两种方法的主要反应原理如下:
湿法制备——2Fe(OH)3+3ClO-+4OH-=2FeO42-+3Cl-+5H2O;
干法制备——2FeSO4 +6Na2O2=2Na2FeO4+2Na2O+2Na2SO4+O2↑。
下列有关说法中错误的是( )
| A.高铁酸钾与水反应时,水发生氧化反应 |
| B.干法中每生成1mol Na2FeO4共转移4mol电子 |
| C.湿法中每生成1mol Na2FeO4共转移3mol电子 |
| D.K2FeO4处理水时,不仅能杀菌,还能除去H2S、NH3等,并使悬浮杂质沉降 |
吸进人体内的氧有2%转化为加速人体衰老的氧化性极强的活性氧,若Na2SeO3能清除人体内活性氧,则Na2SeO3的作用是
| A.还原剂 | B.氧化剂 |
| C.既是氧化剂又是还原剂 | D.既不是氧化剂又不是还原剂 |
高温下焙烧CuFeS2的反应之一为2CuFeS2+7O2=CuSO4+CuO+Fe2O3+3SO2,下列关于该反应的叙述正确的是
| A.CuFeS2中硫的化合价为-1 |
| B.CuFeS2发生还原反应 |
| C.1 mol CuFeS2完全反应转移13 mol电子 |
| D.CuSO4和SO2既是氧化产物,又是还原产物 |
容器中发生一个化学反应,反应过程中存在H2O、H2S、S、NH4+、H+、NO3—六种物质。在反应过程中测得NO3—和S的物质的量随时间变化的曲线如图所示。下列有关判断中正确的是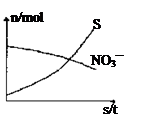
| A.配平后氧化剂与还原剂的化学计量数之比为1:4 |
| B.硫元素在反应中被还原 |
| C.还原剂是含NH4+的物质 |
| D.若生成1molNH4+,则转移电子2mol。 |
现有等物质的量的铜和银的混合物17.2克,与50.0mL的浓硝酸恰好完全反应,产生气体4.48L(标准状况),则下列说法正确的是
| A.产生的气体是0.2molNO2 |
| B.硝酸的物质的量浓度为12mol/L |
| C.反应中被还原和未被还原的硝酸物质的量之比为3:2 |
| D.要使产生的气体恰好完全被水吸收需要通入氧气0.075mol |
新型纳米材料氧缺位铁酸盐(MFe2Ox)(3<x<4;M表示Mn、Co、Zn或Ni的二价离子),常温下,它能使工业废气中的SO2、NO2等氧化物转化为单质。转化流程如图所示,下列有关该转化过程的叙述正确的是( )
| A.MFe2O4表现了还原性 |
| B.MFe2Ox表现了还原性 |
| C.SO2和NO2表现了还原性 |
| D.SO2和NO2发生了分解反应 |
已知氧化性:Cl2> >Fe3+>I2,以下实验的结论或实验的预测合理的是
>Fe3+>I2,以下实验的结论或实验的预测合理的是
| A.往溶液中加入过量的氯水再加淀粉,振荡不出现蓝色,说明没有I- |
| B.向FeCl2溶液中滴加碘水,所得溶液中加入KSCN溶液将呈红色 |
C.向淀粉碘化钾试纸上滴白醋和加碘盐的溶液,试纸变蓝,说明加碘盐中有 |
| D.往FeI2溶液中滴加少量氯水,溶液变成棕黄色,说明有Fe3+生成 |
根据下列反应,可以判断有关物质的氧化性由强到弱的顺序正确的是( )。
①Cl2+2KI=2KCl+I2
②2FeCl2+Cl2=2FeCl3
③2FeCl3+2HI=2FeCl2+2HCl+I2
④H2S+I2=S↓+2HI
| A.H2S>I2>Fe3+>Cl2 | B.Cl2>Fe3+>I2>S |
| C.Fe3+>Cl2>H2S>I2 | D.Cl2>I2>Fe3+>H2S |