题目内容
【题目】氮的氧化物和硫的氧化物是导致酸雨的物质。
(1)形成酸雨的原理之一可简单表示如下:
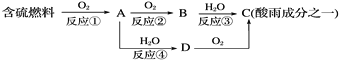
回答下列问题:
①酸雨的pH________(填“>”、“<”或“=”)5.6。
②D物质的化学式为____________。
③反应②的化学方程式为_________________________________________。
(2)在一定条件下氨气亦可用来将氮氧化物转化为无污染的物质。写出氨气和二氧化氮在一定条件下反应的化学方程式:__________________,反应中氧化剂是____________,还原剂是_______________。
(3)用氢氧化钠溶液可以吸收废气中的氮氧化物,反应的化学方程式如下:
NO2+NO+2NaOH===2NaNO2+H2O,2NO2+2NaOH===NaNO2+NaNO3+H2O
现有VL某NaOH溶液能完全吸收n molNO2和m molNO组成的大气污染物。
①所用烧碱溶液的物质的量浓度至少为________ mol·L1。
②若所得溶液中c(NO3—)∶c(NO2—)=1∶9,则原混合气体中NO2和NO的物质的量之比n∶m=______。
③用含n和m的代数式表示所得溶液中NO3—和NO2—浓度的比值c(NO3—)∶c(NO2—)=________。
【答案】 < H2SO3 2SO2+O2![]() 2SO3 6NO2+8NH3
2SO3 6NO2+8NH3![]() 7N2+12H2O NO2 NH3
7N2+12H2O NO2 NH3 ![]() 3∶2
3∶2 ![]()
![]()
【解析】
由图示转化可知:A为SO2,B为SO3,C为H2SO4,D为H2SO3。
(1)酸雨的pH<5.6,正常雨水的pH=5.6;由分析可知D为H2SO3,A为SO2,B为SO3,反应方程式为:2SO2+O2![]() 2SO3,注意此反应是可逆反应,应用可逆符号连接;
2SO3,注意此反应是可逆反应,应用可逆符号连接;
(2)NH3和NO2发生氧化还原反应生成的无污染物质是N2和H2O,反应方程式为:6NO2+8NH3![]() 7N2+12H2O,反应中NO2中N的化合价由+4价降低到0价,得到电子,被还原,本身作氧化剂;NH3中的N由-3价上升到0价,失去电子,被氧化,本身作还原剂。
7N2+12H2O,反应中NO2中N的化合价由+4价降低到0价,得到电子,被还原,本身作氧化剂;NH3中的N由-3价上升到0价,失去电子,被氧化,本身作还原剂。
(3)①因产物NaNO3、NaNO2中n(Na+)=n(N),故n(NaOH)=n(NO)+n(NO2)=(m+n) mol,c(NaOH)= ![]() mol·L-1。②NO2与NO混合气体与NaOH溶液反应可以认为先后发生如下反应:
mol·L-1。②NO2与NO混合气体与NaOH溶液反应可以认为先后发生如下反应:
NO2+NO+2NaOH===2NaNO2+H2O
m m 2m 2m
2NO2+2NaOH===NaNO2+ NaNO3+H2O
n-m ![]() (n-m)
(n-m) ![]() (n-m)
(n-m)
当V(NO)2≥V(NO)时能吸收完全,所以c(NO3-)∶c(NO2-)=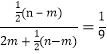 ,得n∶m=3∶2。③c(NO3-)∶c(NO2-)=
,得n∶m=3∶2。③c(NO3-)∶c(NO2-)= ![]() (n-m)∶[2m+
(n-m)∶[2m+ ![]() (n-m)]=
(n-m)]=![]() 。
。

 黄冈小状元解决问题天天练系列答案
黄冈小状元解决问题天天练系列答案 三点一测快乐周计划系列答案
三点一测快乐周计划系列答案【题目】某实验小组欲探究Na2CO3和NaHCO3的性质,发现实验室里盛放两种固体的试剂瓶丢失了标签。于是,他们先对固体A、B进行鉴别,再通过实验进行性质探究。
(1)分别加热固体A、B,发现固体A受热产生的气体能使澄清石灰水变浑浊。A受热分解的化学方程式为_____。
(2)称取两种固体各2g,分别加入两个小烧杯中,再各加10 mL蒸馏水,振荡,测量温度变化;待固体充分溶解,恢复至室温,向所得溶液中各滴入2滴酚酞溶液。
①发现Na2CO3固体完全溶解,而NaHCO3固体有剩余,由此得出结论_________________。
②同学们在两烧杯中还观察到以下现象。其中,属于盛放Na2CO3的烧杯中出现的现象的是______(填字母序号)。
a.溶液温度下降 b.溶液温度升高 c.滴入酚酞后呈浅红色 d.滴入酚酞后呈红色
(3)如图所示,在气密性良好的装置Ⅰ和Ⅱ中分别放入药品,将气球内的固体同时倒入试管中。

①两试管中均产生气体,__________(填“Ⅰ”或“Ⅱ”)的反应程度更为剧烈。
②反应结束后,气球均有膨胀,恢复至室温,下列说法正确的是__________。
a.装置Ⅰ的气球体积较大
b.装置Ⅱ的气球体积较大
c.生成气体的体积根据盐酸计算
d.生成气体的体积根据固体计算
(4)同学们将两种固体分别配制成0.5 mol·L-1的溶液,设计如下方案并对反应现象作出预测:
实验方案 | 预测现象 | 预测依据 |
操作1:向2 mLNa2CO3溶液中滴加1mL 0.5mol·L-1CaCl2溶液 | 有白色沉淀 | Na2CO3溶液中的CO32—浓度较大,能与CaCl2发生反应______________(写离子方程式) |
操作2:向2 mLNaHCO3溶液中滴加1 mL 0.5mol·L-1CaCl2溶液 | 无白色沉淀 | NaHCO3溶液中的CO32—浓度很小,不能与CaCl2反应 |
实际实验后,发现操作2的现象与预测有差异:产生白色沉淀和气体。则该条件下,NaHCO3溶液与CaCl2溶液反应的离子方程式为_______________________________。





