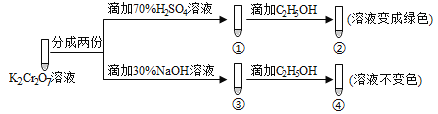
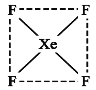
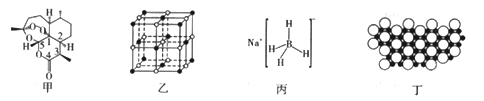
题目内容
【题目】海水中含有大量的氯化镁,从海水中提取镁的生产流程如下图所示:
![]()
回答下列问题:
<span style="font-size: 14px; font-family: "Times New Roman";"><span contenteditable="true">(1)</span></span>写出在海水中加入氧化钙生成氢氧化镁的化学方程式_______________________。操作①的名称________。
(2)加入试剂①,反应的离子方程式为___________________。
(3)操作②的名称__________。
(4)经操作③最终可得金属镁,该反应的化学方程式是________________。
【答案】 CaO+H2O+MgCl2==CaCl2+Mg(OH)2↓ 过滤 Mg(OH)2+2H+=Mg2++2H2O 蒸发结晶 MgCl2![]() Mg+Cl2↑
Mg+Cl2↑
【解析】从海水中提取金属镁的流程:把贝壳制成石灰乳操作①;在引入的海水中加入石灰乳,将海水中含有的镁离子转化为氢氧化镁沉淀,反应方程式为:Mg2++2OH-=Mg(OH)2 ↓;然后将氢氧化镁溶于盐酸中操作②得到氯化镁溶液,反应方程式为:Mg(OH)2 +2HCl=MgCl2+2H2O,用氯化镁溶液在氯化氢氛围中制取无水氯化镁;活泼金属采用电解其熔融盐的方法冶炼,镁是活泼金属,最后利用电解熔融氯化镁的方法冶炼镁操作③,反应方程式为MgCl2![]() Mg+Cl2↑.
Mg+Cl2↑.
(1)在海水中加入氧化钙发生反应:CaO+H2O═Ca(OH)2 ;氢氧化钙和海水中的氯化镁发生复分解反应:MgCl2+Ca(OH)2 ═Mg(OH)2 ↓+CaCl2,所以在海水中加入氧化钙生成氢氧化镁的化学方程式为:CaO+H2O+MgCl2═CaCl2+Mg(OH)2 ↓,氢氧化镁是难溶性的固体,将不溶性的固体和溶液分离的方法是过滤,所以操作①主要是指过滤;(2)将氢氧化镁溶于盐酸中得到氯化镁溶液,不引入其它杂质阴离子,所以试剂①为盐酸,反应为:Mg(OH)2 +2H+═Mg2++2H2O; (3)从溶液中析出固体采用蒸发结晶的方法;(4)镁是活泼金属,工业上采用电解氯化镁的方法冶炼镁,其电解反应方程式为:MgCl2(熔融)![]() Mg+Cl2↑。
Mg+Cl2↑。
点睛: 本题考查了镁的提取,掌握从海水中提取金属镁的流程:先将海水中含有的镁离子转化为氢氧化镁沉淀,然后将氢氧化镁溶于盐酸中得到氯化镁溶液,用氯化镁溶液制取无水氯化镁,最后利用电解熔融氯化镁的方法冶炼镁,是解答的关键,题目难度中等。

 轻松夺冠全能掌控卷系列答案
轻松夺冠全能掌控卷系列答案