题目内容
【题目】![]() I是常规核裂变产物之一,可以通过测定大气或水中
I是常规核裂变产物之一,可以通过测定大气或水中![]() I的含量变化来检测核电 站是否发生放射性物质泄漏。下列有关
I的含量变化来检测核电 站是否发生放射性物质泄漏。下列有关![]() I的叙述中错误的是( )
I的叙述中错误的是( )
A. ![]() I的化学性质与
I的化学性质与![]() I相同B.
I相同B. ![]() I的原子核外电子数为78
I的原子核外电子数为78
C. ![]() I的原子序数为53D.
I的原子序数为53D. ![]() I的原子核内中子数多于质子数
I的原子核内中子数多于质子数
【答案】B
【解析】
利用原子构成,以及质量数=质子数+中子数,进行分析。
A、碘-131和碘-127,互为同位素,核外电子排布相同,化学性质相同,故A说法正确;
B、碘-131的质子数为53,针对原子来说,质子数等于核外电子数,即碘-131的核外电子数为53,故B说法错误;
C、碘-131的质子数为53,质子数等于核电荷数等于原子序数,即原子序数为53,故C说法正确;
D、中子数=131-53=78,而质子数为53,故D说法正确。

 轻松夺冠全能掌控卷系列答案
轻松夺冠全能掌控卷系列答案【题目】有机物A可由葡萄糖发酵得到,也可从酸牛奶中提取。纯净的A为无色黏稠液体,易溶于水。为研究A的组成与结构,进行了如下实验:
实验步骤 | 解释或实验结论 |
(1)称取A 9.0 ,升温使其汽化,测其密度是相同条件下氢气的45倍。 | (1)A的相对分子质量为:___________。 |
(2)将此9.0 gA在足量纯氧气中充分燃烧,并使其产物依次缓缓通过浓硫酸、碱石灰,发现两者分别增重5.4 g和13.2 g。 | (2)A的分子式为:_______________________。 |
(3)另取A 9.0 g,跟足量的碳酸氢钠粉末反应,生成2.24 LCO2(标准状况),若与足量金属钠反应则生成2.24 L氢气(标准状况)。 | (3)写出A中含有的官能团:____、_____。 |
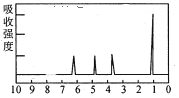
(4)A的核磁共振氢谱如下图:
| (4)A中含有______种氢原子。 |
(5)综上所述A的结构简式_______________________。 | |
【题目】甲醇是重要的工业原料。煤化工可以利用煤炭制取水煤气从而合成甲醇:
CO(g)+2H2(g)![]() CH3OH(g)。
CH3OH(g)。
已知①常压下反应的能量变化如图所示。

②
化学键 | H—H | H—O | O=O |
键能kJ/mol | 436 | x | 496 |
③CO(g)+1/2O2(g)=CO2(g)ΔH=-280 kJ/mol;
H2(g)+1/2O2(g)=H2O(l) ΔH=-284 kJ/mol
H2O(l)=H2O(g) ΔH=+44 kJ/mol
请回答下列问题:
(1)请写出表示气态甲醇燃烧热的热化学方程式_______________________。
(2)H—O键的键能x为________ kJ/mol。
(3)在____(填“高温”或“低温”)情况下有利于CO和H2制备甲醇的反应自发进行。
(4)某兴趣小组同学利用甲醇燃料电池探究电浮选法处理污水的一种方式:保持污水的pH在5.0~6.0之间,通过电解生成Fe(OH)3沉淀。Fe(OH)3具有吸附性,可吸附污物而沉积下来,具有净化水的作用。装置如图所示。

甲 乙
①写出甲池的A极电极反应式:__________________________。
②若乙池实验时污水中离子浓度较小,导电能力较差,净水效果不好,此时应向污水中加入适量的________。
A.H2SO4 B.BaSO4 C.Na2SO4 D.NaOH E.CH3CH2OH
(5)下图是甲醇燃料电池工作的示意图,其中A、B、D均为石墨电极,C为铜电极。工作一段时间后,断开K,此时A、B两极上产生的气体体积相同。
①乙中A极析出的气体在标准状况下的体积为____。
②丙装置溶液中金属阳离子的物质的量与转移电子的物质的量变化关系如图,则图中②线表示的是__________离子的变化;反应结束后,要使丙装置中金属阳离子恰好完全沉淀,需要__________mL 5.0 mol/L NaOH溶液。