题目内容
(1)某温度(t℃)时,测得0.01 mol·L-1 的NaOH溶液的pH=13,请回答下列问题:
①该温度下水的Kw= 。
②此温度下,将pH=a的NaOH溶液VaL与pH=b的H2SO4溶液VbL混合(忽略体积变化),若所得混合液为中性,且a=12,b=2,则Va︰Vb= 。
(2)已知25°C时Ksp(Mg(OH)2)=1.8×10-11,为除去某食盐溶液中的Mg2+,可用NaOH为除杂试剂,当控制溶液PH=12时,可确保Mg2+除尽,此时溶液中Mg2+的物质的量浓度为 .
①该温度下水的Kw= 。
②此温度下,将pH=a的NaOH溶液VaL与pH=b的H2SO4溶液VbL混合(忽略体积变化),若所得混合液为中性,且a=12,b=2,则Va︰Vb= 。
(2)已知25°C时Ksp(Mg(OH)2)=1.8×10-11,为除去某食盐溶液中的Mg2+,可用NaOH为除杂试剂,当控制溶液PH=12时,可确保Mg2+除尽,此时溶液中Mg2+的物质的量浓度为 .
(1)①1.0×10-15 ②10:1 (2)1.8×10-7mol/L。
(1)①0.01 mol·L-1 的NaOH溶液的pOH=2,即pOH+ pH=15,即该温度下水的Kw=1.0×10-15 ;
②所得混合液为中性即氢离子的物质的量与氢氧根离子的物质的量相等;即, ,又a=12,b=2,则Va︰Vb=10:1;
,又a=12,b=2,则Va︰Vb=10:1;
(2)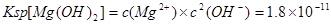 ;当溶液PH=12时即
;当溶液PH=12时即 ,代入
,代入 进而可得此时溶液中Mg2+的物质的量浓度为1.8×10-7mol/L。
进而可得此时溶液中Mg2+的物质的量浓度为1.8×10-7mol/L。
②所得混合液为中性即氢离子的物质的量与氢氧根离子的物质的量相等;即,
 ,又a=12,b=2,则Va︰Vb=10:1;
,又a=12,b=2,则Va︰Vb=10:1;(2)
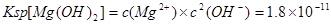 ;当溶液PH=12时即
;当溶液PH=12时即 ,代入
,代入 进而可得此时溶液中Mg2+的物质的量浓度为1.8×10-7mol/L。
进而可得此时溶液中Mg2+的物质的量浓度为1.8×10-7mol/L。
练习册系列答案
 期末集结号系列答案
期末集结号系列答案
相关题目
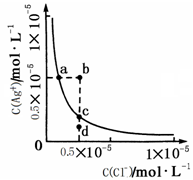
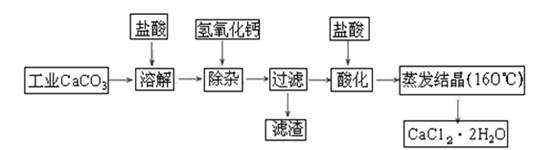 (1)除杂操作是加入氢氧化钙固体,调节溶液的pH为8.0~8.5,以除去溶液中的少量Al3+、Fe3+,检验Fe(OH)3是否沉淀完全的实验操作是_____________________________________
(1)除杂操作是加入氢氧化钙固体,调节溶液的pH为8.0~8.5,以除去溶液中的少量Al3+、Fe3+,检验Fe(OH)3是否沉淀完全的实验操作是_____________________________________
 ______________,
______________, 11mol3·L-3,求该温度下饱和的Mg(OH)2溶液的pH为 。
11mol3·L-3,求该温度下饱和的Mg(OH)2溶液的pH为 。