题目内容
在体积恒定的密闭容器中,一定量的SO2与1mol O2在催化剂作用下加热到600℃发生反应:
2SO2+O2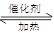 2SO3 △H<0。当气体的物质的量减少0.5mol时反应达到平衡。下列叙述正确的是
2SO3 △H<0。当气体的物质的量减少0.5mol时反应达到平衡。下列叙述正确的是
2SO2+O2
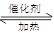 2SO3 △H<0。当气体的物质的量减少0.5mol时反应达到平衡。下列叙述正确的是
2SO3 △H<0。当气体的物质的量减少0.5mol时反应达到平衡。下列叙述正确的是| A.当SO3的生成速率与SO2的消耗速率相等时反应达到平衡 |
| B.降低温度,正反应速率减小程度比逆反应速率减小程度大 |
| C.将平衡混合气体通入过量BaCl2溶液中,会得到两种白色沉淀 |
| D.该反应过程中转移了2mol电子 |
D
试题分析:结合方程式,当气体的物质的量减少0.5mol时消耗氧气0.5mol,转移的电子数为2mol,达平衡时将混合气体通入BaCl2溶液中,会生成BaSO4,降低温度时,正反应速率减小程度小于逆反应速率的减小程度,A项SO3的生成速率与SO2的消耗速率的方向相同,不能确定是否平衡。

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
 CH3CH2OH(g)+H2O(g),下列叙述中能说明上述反应在一定条件下一定达到最大限度的是
CH3CH2OH(g)+H2O(g),下列叙述中能说明上述反应在一定条件下一定达到最大限度的是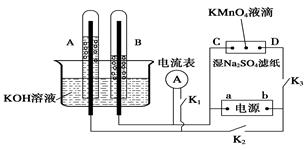
 CH3OH(g) ΔH,下表所列数据是该反应在不同温度下的化学平衡常数(K)。请回答下列问题:
CH3OH(g) ΔH,下表所列数据是该反应在不同温度下的化学平衡常数(K)。请回答下列问题: 4NH3 (g)+3O2 (g) ΔH= a kJ·mol-1
4NH3 (g)+3O2 (g) ΔH= a kJ·mol-1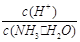 C.c(H+)·c(OH-) D.
C.c(H+)·c(OH-) D.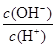
 NH2COONH4(s)。请按要求回答下列问题:
NH2COONH4(s)。请按要求回答下列问题:
 3 C(g)达到平衡时,测得c(A)=0.5 mol/L。在温度不变的情况下,将容器体积增大一倍,当达到新的平衡时,测得c(A)=0.20mol/L。下列判断中正确的是
3 C(g)达到平衡时,测得c(A)=0.5 mol/L。在温度不变的情况下,将容器体积增大一倍,当达到新的平衡时,测得c(A)=0.20mol/L。下列判断中正确的是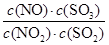 。达到平衡状态时,如果升高温度(其它条件不变),则K值减小。下列说法正确的是( )
。达到平衡状态时,如果升高温度(其它条件不变),则K值减小。下列说法正确的是( ) NO(g)+SO3(g) ΔH>0
NO(g)+SO3(g) ΔH>0 2SO3达到一定限度后通入18O2,一段时间18O可能存在于( )
2SO3达到一定限度后通入18O2,一段时间18O可能存在于( ) 2NH3(g);ΔH=—92.4 kJ/mol。达到平衡时,放出热量46.2 kJ。求:
2NH3(g);ΔH=—92.4 kJ/mol。达到平衡时,放出热量46.2 kJ。求: