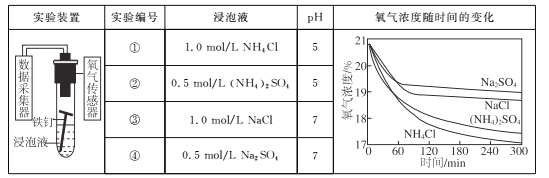
��Ŀ����
����Ŀ�������仯�����ǿ�ѧ����һֱ��̽�������⣬�����ڹ�ũҵ�������������������Ҫ�����á��ش��������⡣
��.��֪H��H���ļ���Ϊ436kJ��mol-1��N��H���Ľ���Ϊ391kJ��mol-1��N![]() N���ļ�����945.6 kJ��mol-1����ӦNH3(g)
N���ļ�����945.6 kJ��mol-1����ӦNH3(g)![]()
![]() N2(g)+
N2(g)+![]() H2(g)����H=______������ij�¶�����ƽ�ⳣ��ΪK����N2(g)+3H2(g)
H2(g)����H=______������ij�¶�����ƽ�ⳣ��ΪK����N2(g)+3H2(g) ![]() 2NH3(g)��ƽ�ⳣ��K1=___________����K��ʾ��
2NH3(g)��ƽ�ⳣ��K1=___________����K��ʾ��
��.�Ȱ�����������������Ӧ���ɵ�һ�����dz��õ�����ˮ��������������Ҫ����һ�Ȱ������Ȱ������Ȱ�(NH2Cl��NHCl2��NCl3)����������������ˮ��������
��1����ҵ�Ͽ����÷�Ӧ2Cl2(g)+NH3(g)![]() NHCl2 (l)+2HCl(g)�Ʊ����Ȱ���
NHCl2 (l)+2HCl(g)�Ʊ����Ȱ���
�����Ȱ������ԡ����Ի����лᷢ��ǿ��ˮ�������ɾ���ǿɱ�����õ����ʣ�д������ǿɱ�����õ����ʵĵ���ʽ_______________________��
���ں��������£���2molCl2��1molNH3����ij�ܱ������з���������Ӧ�����ƽ��ʱCl2��HCl�����ʵ���Ũ����ƽ����ѹ�Ĺ�ϵ��ͼ��ʾ����A��B��C������Cl2ת������ߵ���________���� ����A�� ��B������C����������C��ʱ�÷�Ӧ��ѹǿƽ�ⳣ��Kp(C)=_____________��Kp��ƽ���ѹ����ƽ��Ũ�ȼ��㣬��ѹ= ��ѹ�����ʵ�����������

��2����Cl2��NH3��Ӧ�Ʊ����Ȱ��ķ���ʽΪ3Cl2(g)+NH3(g)![]() NCl3(l)+3HCl(g)�����ݻ���Ϊ1L�ļס���������������Ӧ�¶ȷֱ�Ϊ400�桢T�棩�����зֱ����2molCl2��2molNH3����ø�������n(Cl2)�淴Ӧʱ��t�ı仯������±���ʾ��
NCl3(l)+3HCl(g)�����ݻ���Ϊ1L�ļס���������������Ӧ�¶ȷֱ�Ϊ400�桢T�棩�����зֱ����2molCl2��2molNH3����ø�������n(Cl2)�淴Ӧʱ��t�ı仯������±���ʾ��
t /min | 0 | 40 | 80 | 120 | 160 |
n(Cl2)(������)/mol | 2.00 | 1.50 | 1.10 | 0.80 | 0.80 |
n(Cl2)(������)/mol | 2.00 | 1.45 | 1.00 | 1.00 | 1.00 |
��T��__________400�棨����>������<������
���÷�Ӧ����H__________0������>������<������
���÷�Ӧ�Է����е�������__________������¡����¡��κ��¶�����
���Ը÷�Ӧ������˵����ȷ����_________����ѡ����ĸ����
A.�������������ܶȲ������������Ӧ�ﵽƽ��״̬
B.��������Cl2��NH3���ʵ���֮��Ϊ3��1���������Ӧ�ﵽƽ��״̬
C.��Ӧ�ﵽƽ����������������䣬��ԭ�����а�![]() =
=![]() ��������һ������Ӧ��������ƽ���Cl2��ת��������
��������һ������Ӧ��������ƽ���Cl2��ת��������
D.��Ӧ�ﵽƽ�����������������������һ������NC13��ƽ�⽫���淴Ӧ�����ƶ�
���𰸡�+46.2 kJ��mol��1 ![]()
![]() B 0.5MPa > < ���� AC
B 0.5MPa > < ���� AC
��������
��.��֪H��H���ļ���Ϊ436kJ��mol-1��N��H���Ľ���Ϊ391kJ��mol-1��N![]() N���ļ�����945.6 kJ��mol-1����ӦNH3(g)
N���ļ�����945.6 kJ��mol-1����ӦNH3(g)![]()
![]() N2(g)+
N2(g)+![]() H2(g)����H=3��391kJ/mol -
H2(g)����H=3��391kJ/mol -![]() 945.6 kJ/mol-
945.6 kJ/mol- ![]() 436kJ/mol=+46.2 kJ/mol��NH3(g)
436kJ/mol=+46.2 kJ/mol��NH3(g)![]()
![]() N2(g)+
N2(g)+![]() H2(g)��ƽ�ⳣ��ΪK=
H2(g)��ƽ�ⳣ��ΪK=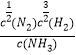 ��N2(g)+3H2(g)
��N2(g)+3H2(g) ![]() 2NH3(g)��ƽ�ⳣ��K1=
2NH3(g)��ƽ�ⳣ��K1=![]() =
=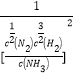 =
=![]() ����.��1���ٶ��Ȱ������ԡ����Ի����лᷢ��ǿ��ˮ�⣬���ɾ���ǿɱ�����õ������Ǵ����ᣬ�����ʽΪ
����.��1���ٶ��Ȱ������ԡ����Ի����лᷢ��ǿ��ˮ�⣬���ɾ���ǿɱ�����õ������Ǵ����ᣬ�����ʽΪ![]() ����A��B��C�����дﵽƽ��״̬��B��HClŨ���������Cl2ת�������ת������ߵ���B�㣻�Ʊ����Ȱ��ķ�ӦΪ2Cl2(g)+NH3(g)
����A��B��C�����дﵽƽ��״̬��B��HClŨ���������Cl2ת�������ת������ߵ���B�㣻�Ʊ����Ȱ��ķ�ӦΪ2Cl2(g)+NH3(g) ![]() NHCl2 (l)+2HCl(g)���ں��������£�1 mol Cl2������NH3������Ӧ��C��ʱ��Cl2��HCl�����ʵ���Ũ����ȣ���֪��ʱ��Ӧ��ϵ��c(Cl2)=1mol��c(HCl)=1mol��c(NH3)=0.5mol�����������ʵķ�ѹ�ֱ�Ϊ��P(Cl2)= P(HCl)=10MPa��
NHCl2 (l)+2HCl(g)���ں��������£�1 mol Cl2������NH3������Ӧ��C��ʱ��Cl2��HCl�����ʵ���Ũ����ȣ���֪��ʱ��Ӧ��ϵ��c(Cl2)=1mol��c(HCl)=1mol��c(NH3)=0.5mol�����������ʵķ�ѹ�ֱ�Ϊ��P(Cl2)= P(HCl)=10MPa��![]() =4MPa��P(NH3)=2MPa��C��ʱ�÷�Ӧ��ѹǿƽ�ⳣ��Kp(C)=
=4MPa��P(NH3)=2MPa��C��ʱ�÷�Ӧ��ѹǿƽ�ⳣ��Kp(C)=![]() =0.5MPa����2�������ݱ������ݿ�֪���÷�Ӧ��T��ʱ��Ӧ���ʿ죬�ﵽƽ��״̬ʱn(Cl2) ������T��400���������¶����ߣ�ƽ�����淴Ӧ�����ƶ���˵���÷�ӦΪ���ȷ�Ӧ��span>��H<0�����÷�Ӧ���Է����У��������G=��H-T��S<0����ӦΪ���������С�ķ��ȷ�Ӧ����Ϊ�ؼ��ķ�Ӧ����G=��H-T��S<0�������ڵ��������£���A����Ӧǰ�����������仯������������䣬�������������ܶȲ��䣬�������Ӧ�ﵽƽ��״̬��ѡ��A��ȷ��B�����ݻ���Ϊ1L�ļס����������£���Ӧ�¶ȷֱ�Ϊ400�桢T�棩�����зֱ����2mol C12��2mol NH3����Ӧ���к����������ﵽCl2��NH3���ʵ���֮��Ϊ3��1��ѡ��B����C.��Ӧ�ﵽƽ����������������䣬��ԭ�����а�
=0.5MPa����2�������ݱ������ݿ�֪���÷�Ӧ��T��ʱ��Ӧ���ʿ죬�ﵽƽ��״̬ʱn(Cl2) ������T��400���������¶����ߣ�ƽ�����淴Ӧ�����ƶ���˵���÷�ӦΪ���ȷ�Ӧ��span>��H<0�����÷�Ӧ���Է����У��������G=��H-T��S<0����ӦΪ���������С�ķ��ȷ�Ӧ����Ϊ�ؼ��ķ�Ӧ����G=��H-T��S<0�������ڵ��������£���A����Ӧǰ�����������仯������������䣬�������������ܶȲ��䣬�������Ӧ�ﵽƽ��״̬��ѡ��A��ȷ��B�����ݻ���Ϊ1L�ļס����������£���Ӧ�¶ȷֱ�Ϊ400�桢T�棩�����зֱ����2mol C12��2mol NH3����Ӧ���к����������ﵽCl2��NH3���ʵ���֮��Ϊ3��1��ѡ��B����C.��Ӧ�ﵽƽ����������������䣬��ԭ�����а�![]() =
=![]() ��������һ������Ӧ���������������������ӷ�Ӧ��൱������ѹǿ��ƽ�������������С������Ӧ�����ƶ��������ƽ���Cl2��ת��������ѡ��C��ȷ��D.��Ӧ�ﵽƽ�����������������������һ������NC13��Ũ�Ȳ��䣬ƽ�ⲻ�ƶ���ѡ��D����ѡAC��
��������һ������Ӧ���������������������ӷ�Ӧ��൱������ѹǿ��ƽ�������������С������Ӧ�����ƶ��������ƽ���Cl2��ת��������ѡ��C��ȷ��D.��Ӧ�ﵽƽ�����������������������һ������NC13��Ũ�Ȳ��䣬ƽ�ⲻ�ƶ���ѡ��D����ѡAC��

 ��������һ���þ�ϵ�д�
��������һ���þ�ϵ�д� Сѧ��10����Ӧ����ϵ�д�
Сѧ��10����Ӧ����ϵ�д�����Ŀ��ijѧϰС�����ӹ�ҵ�Ϸ������л���V2O5��ͨ������֪�÷Ϸ���������Ҫ�ɷ����±�:
���� | V2O5 | V2O4 | K2SO4 | SiO2 | Fe2O3 | Al2O3 |
��������/% | 2.2��29 | 2.8��3.1 | 22��28 | 60��65 | 1��2 | <1 |
����ͨ�����������ҵ�һ�ַϷ������Ļ��չ�������·������:
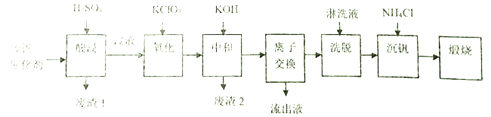
�ش���������:
��1���������ʱV2O5ת��ΪVO2+��V2O4ת��VO2+����������1������Ҫ�ɷ���_____________��
��2������������Ŀ����ʹVO2+��ΪVO2+��д���÷�Ӧ�����ӷ���ʽ________________________��
��3�����к�������֮һ��ʹ����V4O124-��ʽ��������Һ�У���������2���ijɷ���__________(�û�ѧʽ��ʾ)��
��4�������ӽ���������ϴ�����ɼ�ʾΪ:4ROH+ V4O124- ![]() R4V4O12+4OH-(ROHΪ�����������ӽ�����֬)��������Һ����������������_______________��Ϊ�����ϴ��Ч�ʣ���ϴҺӦ�ó�______��(������������������������)��
R4V4O12+4OH-(ROHΪ�����������ӽ�����֬)��������Һ����������������_______________��Ϊ�����ϴ��Ч�ʣ���ϴҺӦ�ó�______��(������������������������)��
��5�����������õ�ƫ�����(NH4VO3)������д���õ������Ļ�ѧ����ʽ__________________��