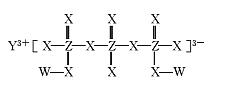题目内容
【题目】高能LiFePO4电池,多应用于公共交通。电池中间是聚合物的隔膜,主要作用是在反应过程中只让Li+通过。结构如图所示:
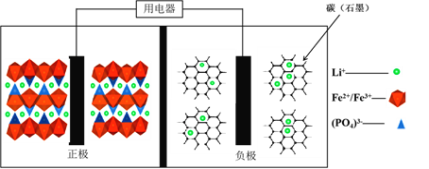
原理如下:(1 x)LiFePO4+xFePO4+LixCn![]() LiFePO4+nC。下列说法不正确的是
LiFePO4+nC。下列说法不正确的是
A.放电时,电子由负极经导线、用电器、导线到正极
B.充电时,Li+向左移动
C.充电时,阴极电极反应式:xLi++xe +nC=LixCn
D.放电时,正极电极反应式:xFePO4+xLi++xe =xLiFePO4
【答案】B
【解析】
A. 原电池中电子流向是负极导线用电器导线正极,则放电时,电子由负极经导线、用电器、导线到正极,故A正确,但不符合题意;
B. 充电过程是电解池,左边正极作阳极,右边负极作阴极,又阳离子移向阴极,所以Li+向右移动,故B错误,符合题意;
C. 充电时,阴极C变化为LixCn,则阴极电极反应式:xLi++xe +nC=LixCn,故C正确,但不符合题意;
D. 放电正极上FePO4得到电子发生还原反应生成LiFePO4,正极电极反应式:xFePO4+xLi++xe =xLiFePO4,故D正确,但不符合题意;
故选:B。

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目