题目内容
14.两种金属粉末混合物13g,投入足量的稀硫酸中,在标准状况下产生11.2L气体,则这种混合物可能是( )| A. | Zn和Cu | B. | Fe和Zn | C. | Al和Fe | D. | Fe和Cu |
分析 假设金属与硫酸反应都为+2价,根据电子转移守恒计算金属物质的量,再根据M=$\frac{m}{n}$计算金属的平均摩尔质量,平均摩尔质量应介于各组分之间,若金属不与稀硫酸反应,其相对原子质量可以视作无穷大;若Al为+2价时,其摩尔质量为$\frac{2}{3}$×27g/mol=18g/mol,据此进行解答.
解答 解:标准状况下,11.2L氢气的物质的量为$\frac{11.2L}{22.4L/mol}$=0.5mol,
假设金属都为+2价,根据电子转移守恒可知,金属的物质的量为0.5mol,则金属混合物的平均摩尔质量为:$\frac{13g}{0.5mol}$=26g/mol,
A.Zn的摩尔质量为65g/mol,Cu不与稀硫酸反应,则二者的平均摩尔质量一定大于26,不符合条件,故A错误;
B.Zn的摩尔质量为65g/mol,Fe的摩尔质量为56g/mol,二者的平均摩尔质量大于26g/mol,不符合题意,故B错误;
C.Fe的摩尔质量为56g/mol,若Al为+2价时,其摩尔质量为$\frac{2}{3}$×27g/mol=18g/mol,二者的平均摩尔质量可能为26,故C正确;
D.Fe的摩尔质量为56g/mol,Cu不与稀硫酸反应,则二者的平均摩尔质量一定大于26,不符合条件,故D错误;
故选C.
点评 本题考查混合物的计算,题目难度中等,本题利用平均值法即可快速解答,注意化合价与摩尔质量的转化,试题培养了学生的分析能力及化学计算能力.

练习册系列答案
相关题目
4.下列化学用语正确的是( )
| A. | 乙烯的结构式:CH2=CH2 | B. | Clˉ的结构示意图: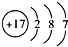 | ||
| C. | I-131:${\;}_{53}^{78}$I | D. | Na2S 的电子式: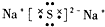 |
5.下列各组物质能发生铝热反应的是( )
| A. | 铝粉和稀盐酸 | B. | 木炭粉和氧化铜粉末 | ||
| C. | 铝粉和FeO粉末 | D. | 铝粉和MgO粉末 |
2.如图是某学校实验室从化学试剂商店买回的硝酸试剂标签上的部分内容.据此下列说法错误的是( )

| A. | 该硝酸的物质的量浓度约为15.1mol•L-1 | |
| B. | 0.3molCu与足量的该硝酸反应产生6gNO | |
| C. | 该硝酸盛放在棕色的玻璃试剂瓶中 | |
| D. | 等体积的水与该硝酸混合所得溶液的溶质质量分数大于34% |
9.把一定质量的a、b、c、d四种物质放入一密闭容器中,在一定条件下反应一段时间后,则得反应后各物质的质量如下.下列说法中正确的是( )
| 物质 | a | b | c | d |
| 反应前的质量(g) | 6.4 | 3.2 | 4.0 | 2.8 |
| 反应后的质量(g) | 5.2 | X | 7.2 | 2.8 |
| A. | a和c是反应物 | B. | d一定是催化剂 | ||
| C. | X=2.0g | D. | 该反应是化合反应 |
19.下列说法正确的是( )
| A. | 化学变化过程,一定会破坏旧的化学键,同时形成新的化学键 | |
| B. | 在化学反应中,破坏旧化学键吸收的能量小于形成新化学键释放的能量时,该反应是吸热反应 | |
| C. | 含有共价键的化合物必是共价化合物 | |
| D. | 需要加热才能发生的反应一定是吸热反应 |
6.下列物质中与CH3-CH2-CH2-CH3互为同分异构体的是( )
| A. | CH3-CH3 | B. | CH3-CH2-CH3 | C. | 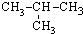 | D. | 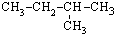 |
3.以下最接近阿伏加德罗常数的值的是( )
| A. | 2.0 L 1.0 mol•L-1CH3COOH溶液中的H+数 | |
| B. | 2.0 L 1.0 mol•L-1 CH3COONa溶液中的CH3COO-数 | |
| C. | 1.0 L 1.0 mol•L-1 NaHCO3 溶液中的HCO3-数 | |
| D. | 1.0 L 1.0 mol•L-1 Na2CO3溶液中的CO32-数 |
4.下列各种冶炼方法中,可制得相应金属的为( )
| A. | 加热氧化铝 | B. | 电解熔融氯化镁 | C. | 加热碳酸钠 | D. | 电解饱和食盐水 |