题目内容
实验室可以通过三条途径来制取氮气:
①加热条件下用NH3还原CuO制得纯净的N2和活性铜粉,反应的化学方程式为:3CuO+2NH3 N2+3Cu+3H2O
N2+3Cu+3H2O
②将空气通过灼热的活性铜粉制得较纯净的N2
③加热NaNO2(有毒性)与NH4Cl的混合浓溶液制取N2,反应的化学方程式为:NaNO2+NH4Cl NaCl+N2↑+2H2O.
NaCl+N2↑+2H2O.
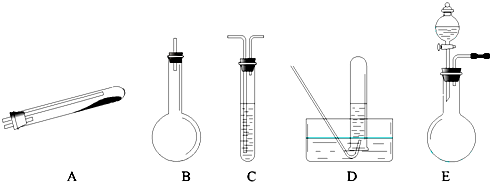
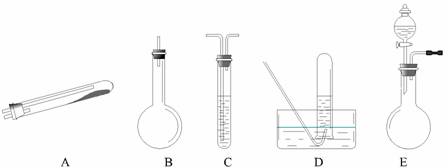
按上述途径制N2可供选择的实验仪器如图所示,其他必要的仪器如铁架台、铁夹、铁圈、石棉网、酒精灯等未列出.

(1)按途径①制取N2时所需的氨气要用浓氨水与生石灰作原料制取,化学方程式为:CaO+NH3?H2O=Ca(OH)2+NH3↑,最好要用上述仪器中______的(填仪器字母,下同)作为氨气发生装置.要制取并收集纯净的N2(允许含少量的水蒸气),还应使用到上述仪器中的______.
(2)①和②两种途径常常被协同使用.这种方法与途径 ③相比优点是______.
(3)检查 E 装置气密性的方法是______.利用 E 装置还可以制取的气体有______(写出三种).
解:(1) 浓氨水易挥发,CaO固体与水反应放出大量的热,导致温度升高,使得氨气在水中的溶解度进一步减少,以气体的形式逸出,制得氨气,题中所给的装置,适用于制备气体的发生装置的是BE,E装置的优点是能控制反应的速率,而B装置只能一次性加入药品,无法控制反应的速率,所以选择图中的E装置,发生的化学反应为:NH3?H2O+CaO═Ca(OH)2+NH3↑,按方法a制取N2中会含有未反应的氨气,因此,还需要用试剂吸收氨气,由于氨气是一种极易溶于水的气体,所以用排水法收集氮气,即可除去氮气中含有的氨气,所以还需使用的装置是AD或ACD;
故答案为:E;A、D或A、C、D;
(2) ①②反应原理简单,原料来源多,铜和氧化铜可以循环利用,无有毒物质参加;
故答案为:Cu 和 CuO 可以循环使用,避免了使用有毒物质;
(3)装置E的气密性检查,可以先关闭止水夹,利用分液漏斗加入水后,打开分液漏斗活塞,观察水是否全部流下,若不能全部流下,说明气密性完好;E装置的条件是固体和液体不加热制备气体,H2、O2、CO2、C12、SO2、NO2、NO等气体制备都符合;
故答案为:用止水夹夹紧 E 中乳胶管,向分液漏斗中加入适量水,打开活塞,若最终液面保持恒定,则证明该装置不漏气;H2、O2、CO2、C12、SO2、NO2、NO等;
分析:(1)用生石灰和浓氨水作原料制取氨气,需选择固体和液体不需要加热制取气体的装置,提供的装置BE符合条件,但B只能一次性加入药品,无法控制反应的速率,所以选择E,根据制取并收集纯净的N2的原理选择装置;
(2)依据制备过程分析,①②中Cu 和 CuO 可以循环使用,避免了使用有毒物质;
(3)检查 E 装置气密性的方法是;关闭止水夹,利用分液漏斗加入水后,打开分液漏斗活塞,观察水是否全部流下分析回答;E装置可以制备固体和液体混合不需要加热的物质制备,依据常见物质制备分析;
点评:本题考查了实验制备气体的装置分析和条件应用,气密性检查方法的判断,依据反应物状态和反应是否加热选择装置是解题关键,题目难度中等.
故答案为:E;A、D或A、C、D;
(2) ①②反应原理简单,原料来源多,铜和氧化铜可以循环利用,无有毒物质参加;
故答案为:Cu 和 CuO 可以循环使用,避免了使用有毒物质;
(3)装置E的气密性检查,可以先关闭止水夹,利用分液漏斗加入水后,打开分液漏斗活塞,观察水是否全部流下,若不能全部流下,说明气密性完好;E装置的条件是固体和液体不加热制备气体,H2、O2、CO2、C12、SO2、NO2、NO等气体制备都符合;
故答案为:用止水夹夹紧 E 中乳胶管,向分液漏斗中加入适量水,打开活塞,若最终液面保持恒定,则证明该装置不漏气;H2、O2、CO2、C12、SO2、NO2、NO等;
分析:(1)用生石灰和浓氨水作原料制取氨气,需选择固体和液体不需要加热制取气体的装置,提供的装置BE符合条件,但B只能一次性加入药品,无法控制反应的速率,所以选择E,根据制取并收集纯净的N2的原理选择装置;
(2)依据制备过程分析,①②中Cu 和 CuO 可以循环使用,避免了使用有毒物质;
(3)检查 E 装置气密性的方法是;关闭止水夹,利用分液漏斗加入水后,打开分液漏斗活塞,观察水是否全部流下分析回答;E装置可以制备固体和液体混合不需要加热的物质制备,依据常见物质制备分析;
点评:本题考查了实验制备气体的装置分析和条件应用,气密性检查方法的判断,依据反应物状态和反应是否加热选择装置是解题关键,题目难度中等.

练习册系列答案
相关题目