题目内容
【题目】在一密闭容器中进行以下可逆反应:M(g)+N(g) ![]() P(g)+2L在不同的条件下P的百分含量P %的变化情况如下图,则该反应( )
P(g)+2L在不同的条件下P的百分含量P %的变化情况如下图,则该反应( )
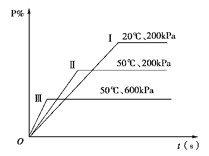
A.正反应放热,L是固体
B.正反应放热,L是气体
C.正反应吸热,L是气体
D.正反应放热,L是固体或气体
【答案】B
【解析】
试题分析:要判断L的状态就要看压强的改变和P的百分含量P%的关系,温度在50℃时,比较曲线Ⅱ、Ⅲ,曲线Ⅲ的压强较大,但P的百分含量P%较小,说明增大压强平衡向逆向移动,则左边气体的化学计量数要小,右边气体的而化学计量数大,那么L一定是气体;在比较曲线Ⅰ和Ⅱ,可以看出压强相等时,温度越高P的百分含量P%越小,说明升高温度平衡向逆向移动,则该反应是放热反应,故B正确。

练习册系列答案
相关题目