题目内容
【题目】煤矸石是采煤过程和洗煤过程中排放的固体废物,其主要成分是Al2O3、SiO2,此外还含有FeO、Fe2O3等杂质。煤矸石经处理后,可用于制备铵明矾等。
已知:i.SiO2不与硫酸反应;Al2O3能与H2SO4反应。
ii.Fe3+、Fe2+、Al3+开始沉淀、完全沉淀的pH如表所示。
Fe2+ | Fe3+ | Al3+ | |
开始沉淀的pH | 6.3 | 1.5 | 3.4 |
完全沉淀的pH | 8.3 | 2.8 | 4.7 |
iii.NH4Al(SO4)2·12H2O的摩尔质量为453g·mol-1。
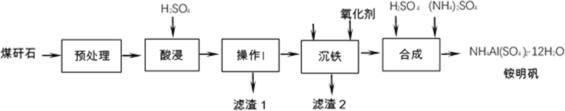
(1)酸浸过程中,Fe2O3与硫酸反应的离子方程式为___________
(2)下列说法中,正确的是___________(填字母)。
a.预处理时,粉碎煤矸石有利于提高酸浸反应速率 b.操作I是过滤 c.滤渣1中一定含有硅元素
(3)沉铁过程中,加入氧化剂的作用是___________
(4)制备过程中,若需检验滤渣1中含有![]() ,实验方案为:取少量滤渣1的洗涤液,向其中加入___________(填试剂和现象),说明其中含有
,实验方案为:取少量滤渣1的洗涤液,向其中加入___________(填试剂和现象),说明其中含有![]() 。
。
【答案】Fe2O3+6H+═2Fe3++3H2O abc 将Fe2+氧化为Fe3+,以便将其转化为沉淀除去 稀HCl酸化,再滴加BaCl2溶液,有白色沉淀生成
【解析】
矸石(主要成分Al2O3、SiO2,还含有FeO、Fe2O3等杂质)先预处理,然后用硫酸酸浸,只有SiO2不反应,操作Ⅰ为过滤,滤渣1为SiO2;滤液中含有铝离子、亚铁离子、铁离子等金属离子,加入氧化剂将Fe2+氧化为Fe3+,同时调节溶液pH除去杂质铁元素,过滤得到的滤渣2为氢氧化铁;滤液中含有硫酸铝,加入稀硫酸、硫酸铵合成NH4Al(SO4)212H2O,据此解答。
(1)Fe2O3与硫酸反应生成硫酸铁和水,该反应的离子方程式为Fe2O3+6H+═2Fe3++3H2O;
(2)a.预处理时,粉碎煤矸石可增大接触面积,有利于提高酸浸反应速率,故a正确;
b.操作Ⅰ为分离出不溶解的二氧化硅,操作方法是过滤,故b正确;
c.加入硫酸酸浸,Al2O3、FeO、Fe2O3都与硫酸反应,而SiO2不与硫酸反应,所以滤渣1中一定含有SiO2,故c正确;
故答案为:abc;
(3)根据表中数据可知,亚铁离子不易沉淀,Fe3+更容易生成氢氧化铁沉淀,则加入氧化剂将Fe2+氧化为Fe3+,以便将其转化为沉淀除去;
(4)检验滤渣1中是否含有SO42-,具体操作是取少量滤渣1的洗涤液,向其中加入稀HCl酸化,再滴加BaCl2溶液,有白色沉淀生成,说明滤渣1中含有SO42-。