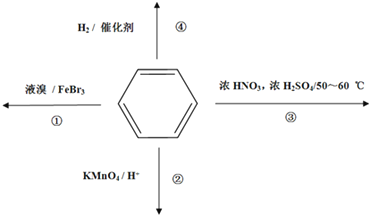
题目内容
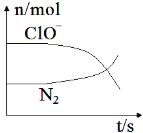
【题目】某离子反应涉及到 H2O、ClO-、NH4+、OH-、N2、Cl-等微粒,其中N2、ClO-的物质的量随时间变化的曲线如图所示,下列说法不正确的是 ( )
A. 该反应中Cl-为还原产物
B. 氧化剂与还原剂物质的量比为3:2
C. 消耗1 mol还原剂,转移6 mol电子
D. 氧化性:ClO-比 N2强
【答案】C
【解析】
从图示中可以看出,ClO-随反应的进行而减小,应是反应物,N2的量随反应的进行而增加,应是生成物。根据原子守恒、得失电子守恒和电荷守恒可以写出发生反应的离子方程式为:3ClO-+2NH4++2OH-=N2↑+3Cl-+5H2O、
A.该反应中氯元素的化合价从+1价降为-1价,Cl-是还原产物,A项正确;
B.该反应中氧化剂是ClO-,还原剂是NH4+,依离子方程式可以看出其物质的量之比为3:2,B项正确;
C.NH4+是还原剂,每消耗2molNH4+,转移的电子数才为6 mol,C项错误;
D.在该反应中,ClO-是氧化剂,N2是氧化产物,所以氧化性:ClO->N2,D项正确;
所以答案选择C项。

【题目】减少氮的氧化物和碳的氧化物在大气中的排放是环境保护的重要内容之一。合理应用和处理碳、氮及其化合物,在生产生活中有重要意义。
(1)对温室气体二氧化碳的研究一直是科技界关注的重点。在催化剂存在下用H2还原CO2 是解决溫室效应的重要手段之一,相关反应如下:
已知H2 和CH4的燃烧热分别为285.5kJ/mol 和890.0kJ/mol。
H2O(1) =H2O(g) △H= +44 kJ/mol
试写出H2 还原CO2 生成CH4和H2O(g)的热化学方程式_____________。
(2)CO2在Cu-ZnO催化下,可同时发生如下的反应I、II,其可作为解决温室效应及能源短缺的重要手段。
I.CO2(g) +3H2(g)![]() CH3OH(g) +H2O(g) △H1=-57.8 kJ/mol
CH3OH(g) +H2O(g) △H1=-57.8 kJ/mol
II.CO2(g) +H2(g)![]() CO(g) + H2O(g) △H2 = +41.2 kJ/mol
CO(g) + H2O(g) △H2 = +41.2 kJ/mol
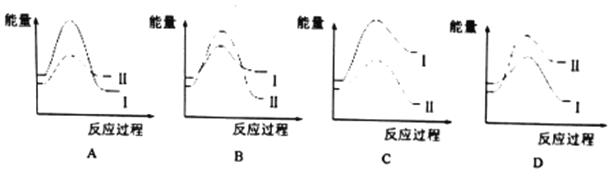
①某温度时,若反应I的速度v1大于反应II的速度以v2,则下列反应过程的能量变化正确的是_______(填选项)。
②对于气体参加的反应,,表示平衡常数Kp时,用气体组分(B)的平衡分压p(B)代替该气体物质的量浓度c(B)。
已知:气体各组分的分压p(B),等于总压乘以其体积分数。
在Cu-ZnO存在的条件下,保持温度T时,在容积不变的密闭容器中,充入一定量的CO2 及H2,起始及达平衡时,容器内各气体物质的量如下表:
CO2 | H2 | CH3OH | CO | H2O(g) | 总压/kPa | |
起始/mol | 5.0 | 7.0 | 0 | 0 | 0 | p0 |
平衡/mol | n1 | n2 | p |
若反应I、II均达平衡时,P0=1.2p,则表中n1=____;若此时
(3)汽车尾气是雾霾形成的原因之一。研究氮氧化物的处理方法可有效减少雾霾的形成,可采用氧化还原法脱硝:
4NO(g) +4NH3(g) +O2(g) ![]() 4N2(g) +6H2O(g) △H <0
4N2(g) +6H2O(g) △H <0
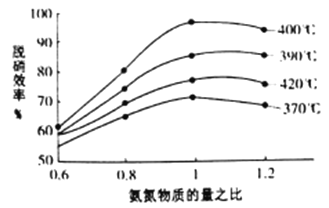
根据下图判断提高脱硝效率的最佳条件是________;氨氮比一定时,在400℃时,脱硝效率最大,其可能的原因是______________。
(4)用活性炭还原法也可以处理氮氧化物,某研究小组向某密闭容器加入一定量的活性炭和NO,发生反应:C(s) +2NO(g)![]() N2(g) +CO2(g) △H>0
N2(g) +CO2(g) △H>0
在T℃时,反应进行到不同时间测得各物质的量浓度如下:
时间/min 浓度/(mol/L) | 0 | 10 | 20 | 30 | 40 | 50 |
NO | 1.0 | 0.58 | 0.40 | 0.40 | 0.48 | 0.48 |
N2 | 0 | 0.21 | 0.30 | 0.30 | 0.36 | 0.36 |
CO2 | 0 | 0.21 | 0.30 | 0.30 | 0.36 | 0.36 |
30min后,只改变某一条件,根据上表的数据判断改变的条件可能是_______。
A.通入一定量的CO2 B.加入合适的催化剂 C.适当缩小容器的体积
D.通入一定量的NO E.加入一定量的活性炭 F.适当升高温度