题目内容
【题目】T℃时,在2 L的密闭容器中,A气体与B气体发生可逆反应生成C气体,
反应过程中A、B、C物质的量变化如下图(Ⅰ)所示。若保持其它条件不变,
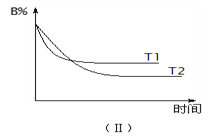
温度分别为T1和T2时,B的物质的量分数与时间关系如下图(Ⅱ)所示。下列
叙述正确的是
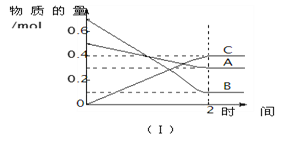
A. 2 min内A的化学反应速率为0.1 mol/(L·min)
B. 在反应达平衡时,保持其他条件不变,增大压强,正逆反应速率都增大,且平衡向逆反应方向移动
C. 在反应达平衡时,其它条件不变,升高温度,正逆反应速率都增大,且A的转化率增大
D. 在T℃时,若A的浓度减少了0.1 mol/L,则B的浓度会减少0.3 mol/L,C的浓度会增加0.2 mol/L
【答案】D
【解析】A、2min时反应达平衡,A的物质的量变化量为0.5mol-0.2mol=0.2mol,v(A)=  =0.05mol/(L
=0.05mol/(L![]() min),选项A错误;B、由图Ⅰ可知,A、B、C的物质的量变化量分别为0.2mol、0.6mol、0.4mol,化学计量数之比等于物质的量之比为0.2mol:0.6mol:0.4mol=1:3:2,反应方程式为A+3B
min),选项A错误;B、由图Ⅰ可知,A、B、C的物质的量变化量分别为0.2mol、0.6mol、0.4mol,化学计量数之比等于物质的量之比为0.2mol:0.6mol:0.4mol=1:3:2,反应方程式为A+3B![]() 2C,增大压强,正逆反应速率都增大,平衡向体积向正反应方向移动,选项B错误;C、由图Ⅱ可知,T 1 先到达平衡,故温度T 1 >T 2 ,温度越高B的物质的量分数越高,升高温度正逆反应速率都增大,平衡向逆反应移动,A的转化率减小,选项C错误;D、浓度变化量之比等于化学计量数之比,故若A的浓度减少了1 mol/L,则B的浓度会减少为2×1 mol/L=3 mol/L,C的浓度会增加为2×1 mol/L=2 mol/L,选项D正确。答案选D。
2C,增大压强,正逆反应速率都增大,平衡向体积向正反应方向移动,选项B错误;C、由图Ⅱ可知,T 1 先到达平衡,故温度T 1 >T 2 ,温度越高B的物质的量分数越高,升高温度正逆反应速率都增大,平衡向逆反应移动,A的转化率减小,选项C错误;D、浓度变化量之比等于化学计量数之比,故若A的浓度减少了1 mol/L,则B的浓度会减少为2×1 mol/L=3 mol/L,C的浓度会增加为2×1 mol/L=2 mol/L,选项D正确。答案选D。

【题目】下列说法正确的是
A. 活化分子之间的碰撞即为有效碰撞
B. 增大压强不能降低活化能,但能增加活化分子百分数
C. 活化能的大小决定了反应能否自发进行
D. 使用催化剂能降低活化能,增加活化分子百分数
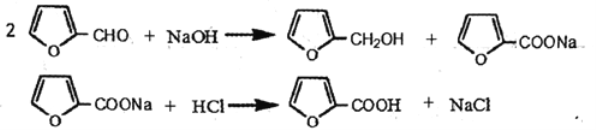
【题目】糠酸又称呋喃甲酸,在食品工业作防腐剂,还可用于合成树脂或医药、香料等的中 间体。以米槺或玉米芯提取的呋喃甲醛为原料合成糠酸反应如下
几种有机物性质如下:
名称 | 性状 | 相对分 子质量 | 溶解度 | |||
冷水 | 热水 | 乙醇 | 乙醚 | |||
呋喃甲醛 | 无色液体 | 96 | 微溶 | 易溶 | 易溶 | 互溶 |
呋喃甲醇 | 无色液体 | 98 | 互溶 | 互溶 | 易溶 | 易溶 |
呋喃甲酸 | 无色晶体 | 112 | 微溶 | 易溶 | 可溶 | 易溶 |
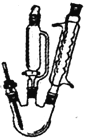
刚果红试纸pH变色范围:3.0(蓝紫色)~5.0(红色)
呋喃甲酸的实验室制备方法如下:
三颈瓶中放人3.28mL(0.04mol)新蒸呋喃甲醛,控温8~12℃下滴加4mL40%NaOH溶液,并
磁力搅拌回流30分钟。向反应混合物滴加蒸馏水(约15mL)使其恰好澄清,用50mL乙醚萃取分液,其水溶液用水蒸气蒸馏,弃去镏出物,慢慢滴加2:1盐酸到pH=3,搅拌,析出结晶,抽滤并用少量水洗涤抽干,得精产品1.75g。
回答以下问题:
(1) 三颈瓶中反应需要搅拌回流30分钟的原因是__________。
(2) 呋喃甲醛在碱中反应大量放热,实验中需要控温8-12℃,其操作方法_________。
(3)50mL乙醚萃取分液,除去呋喃甲醇的操作方法是____________。
A、 直接用50mL乙醚萃取分液
B、 将溶液分两份,乙醚也分两份,分别萃取,萃取液合并
C、 先用30mL乙醚萃取分液,再分别州l0mL乙醚萃取两次,并将三次萃取液合并
(4)乙醚提取后的水溶液要用盐酸酸化。配制100mL 2:1稀盐酸(水与盐酸体积比)的方法是___________;判断盐酸加入足量的方法是________________。
(5)乙醚易挥发、易燃,蒸气可使人失去知觉,在蒸馏回收乙醚时注意:_____________;水蒸气蒸馏的方法应选择________(填字母序号);
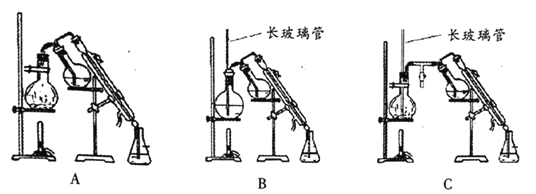
(6)算呋喃甲酸的产率___________________。