题目内容
【题目】重铬酸钾是工业生产和实验室的重要氧化剂,工业上常用铬铁矿(主要成分为FeO·Cr2O3)为原料生产,实验室模拟工业法用铬铁矿制K2Cr2O7的主要工艺如下,请回答下列问题:
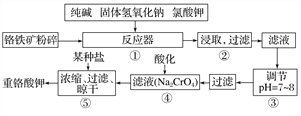
(1)以上工艺流程所涉及元素中属于过渡元素的有________,铁在周期表中的位置是第______周期______族。
(2)在反应器①中,有Na2CrO4生成,同时Fe2O3转变为NaFeO2,杂质SiO2、Al2O3与纯碱反应转变为可溶性盐,写出氧化铝与碳酸钠反应的化学方程式:_________________。
(3)NaFeO2能发生强烈水解,在步骤②中生成沉淀而除去,写出该反应的化学方程式:_________________。
(4)流程④中酸化所用的酸和流程⑤中所用的某种盐最合适的是____________(填字母)。
A.盐酸和氯化钾 B.硫酸和氯化钾 C.硫酸和硫酸锌 D.次氯酸和次氯酸钾
酸化时,CrO![]() 转化为Cr2O
转化为Cr2O![]() ,写出平衡转化的离子方程式:________________。
,写出平衡转化的离子方程式:________________。
(5)水溶液中的H+是以H3O+的形式存在,H3O+的电子式为_____________。
(6)简要叙述操作③的目的:________________。
【答案】 Fe、Cr 四 Ⅷ Al2O3+Na2CO3![]() 2NaAlO2+CO2↑ NaFeO2+2H2O===Fe(OH)3↓+NaOH B 2CrO
2NaAlO2+CO2↑ NaFeO2+2H2O===Fe(OH)3↓+NaOH B 2CrO![]() +2H+
+2H+![]() Cr2O
Cr2O![]() +H2O
+H2O 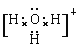 由于溶液中硅酸钠和偏铝酸钠发生水解,SiO
由于溶液中硅酸钠和偏铝酸钠发生水解,SiO![]() +H2O
+H2O![]() HSiO
HSiO![]() +OH-,HSiO
+OH-,HSiO![]() +H2O
+H2O![]() H2SiO3+OH-,AlO
H2SiO3+OH-,AlO![]() +2H2O
+2H2O![]() Al(OH)3+OH-,降低pH有利于平衡向正反应方向移动,当pH调到7~8时,使它们水解完全
Al(OH)3+OH-,降低pH有利于平衡向正反应方向移动,当pH调到7~8时,使它们水解完全
【解析】工业上常用铬铁矿(主要成分为FeOCr2O3)为原料生产重铬酸钾:在反应器①中,6FeOCr2O3+24NaOH+7KClO3=12Na2CrO4+3Fe2O3+7KCl+12H2O,有Na2CrO4生成,同时Fe2O3转变为NaFeO2,NaFeO2能强烈水解,为强碱弱酸液,水解呈碱性,生成氢氧化铁沉淀,反应的化学方程式为NaFeO2+2H2O=Fe(OH)3↓+NaOH,降低pH有利于水解平衡向正反应方向移动,当pH调到7~8时能使它们完全水解生成沉淀,操作④中酸化时,CrO42-转化为Cr2O72-,常温下重铬酸钾的溶解度较小,操作⑤中利用Na2Cr2O7+2KCl=K2Cr2O7+2NaCl复分解反应,得到重铬酸钾,据此解答。
(1)以上工艺流程所涉及元素中属于过渡元素的有Fe、Cr,铁的原子序数是26,在周期表中的位置是第四周期Ⅷ族。(2)氧化铝与碳酸钠反应生成偏铝酸钠和CO2,反应的化学方程式为Al2O3+Na2CO3![]() 2NaAlO2+CO2↑。(3)NaFeO2水解的化学方程式为NaFeO2+2H2O=Fe(OH)3↓+NaOH。(4)盐酸易挥发,所以最好用硫酸。次氯酸钾具有强氧化性,不适合与铬酸钾发生复分解反应生成重铬酸钾,应该用氯化钾,答案选B。酸化时铬酸根转化为重铬酸根离子的离子方程式为2CrO42-+2H+Cr2O72-+H2O。(5)氢离子和水分子之间存在配位键,H3O+的电子式为
2NaAlO2+CO2↑。(3)NaFeO2水解的化学方程式为NaFeO2+2H2O=Fe(OH)3↓+NaOH。(4)盐酸易挥发,所以最好用硫酸。次氯酸钾具有强氧化性,不适合与铬酸钾发生复分解反应生成重铬酸钾,应该用氯化钾,答案选B。酸化时铬酸根转化为重铬酸根离子的离子方程式为2CrO42-+2H+Cr2O72-+H2O。(5)氢离子和水分子之间存在配位键,H3O+的电子式为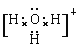 。(6)在反应器①杂质SiO2、Al2O3与纯碱反应转变为可溶性盐,过滤后中溶液中含有铬酸根、偏铝酸根离子,需要通过调节pH转化为沉淀而除去,由于硅酸钠和偏铝酸钠在溶液中发生水解,SiO32-+H2OHSiO
。(6)在反应器①杂质SiO2、Al2O3与纯碱反应转变为可溶性盐,过滤后中溶液中含有铬酸根、偏铝酸根离子,需要通过调节pH转化为沉淀而除去,由于硅酸钠和偏铝酸钠在溶液中发生水解,SiO32-+H2OHSiO