题目内容
下列叙述错误的是( )
A.10mL质量分数为98%的H2SO4,用10mL水稀释后,H2SO4的质量分数大于49%
B.配制0.1mol/L的Na2CO3溶液480mL,需用500ml容量瓶
C.在标况下,将22.4L氨气溶于1L水中,得到1mol/L的氨水
D.同温同压下,20mLCH4和60mLO2所含的原子数之比为5:6
练习册系列答案
相关题目
下列实验操作及现象和后面结论对应正确的是( )
选项 | 实验操作 | 现象 | 结论 |
A | 将SO2通入酸性高锰酸钾溶液 | 高锰酸钾溶液紫色褪色 | SO2具有漂白性 |
B | 向某溶液中滴加KSCN溶液 | 溶液显红色 | 原溶液中有Fe3+无Fe2+ |
C | 将稀硫酸滴入碳酸钠溶液中产生的气体通入硅酸钠溶液 | 有白色沉淀生成 | 证明非金属性S>C>Si |
D | 用坩埚钳夹住一小块用砂纸仔细打磨过的铝箔在酒精灯上加热 | 熔化后的液态铝滴落下来 | 金属铝的熔点较低 |


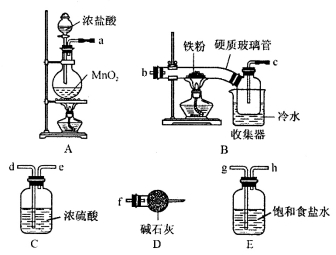
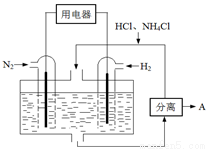
 水氯化铁在空气中易潮解,加热易升华;②工业上,向500—600℃的铁屑中通入氯气可生产无水氯化铁;③向炽热铁屑中通入氯化氢可以生产无水氯化亚铁和氢气。
水氯化铁在空气中易潮解,加热易升华;②工业上,向500—600℃的铁屑中通入氯气可生产无水氯化铁;③向炽热铁屑中通入氯化氢可以生产无水氯化亚铁和氢气。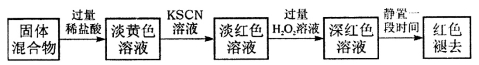
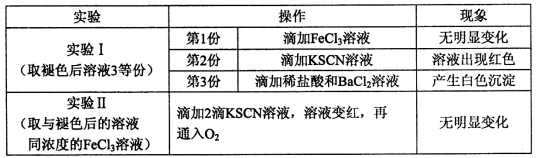
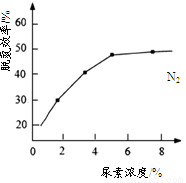
 CO(NH2)2(l)+H2O(g)在合成塔中进行。下图中Ⅰ、Ⅱ、Ⅲ三条曲线为合成塔中按不同氨碳比 [n(NH3)/n(CO2)]和水碳比[n(H2O)/n(CO2)]投料时二氧化碳转化率的情况。
CO(NH2)2(l)+H2O(g)在合成塔中进行。下图中Ⅰ、Ⅱ、Ⅲ三条曲线为合成塔中按不同氨碳比 [n(NH3)/n(CO2)]和水碳比[n(H2O)/n(CO2)]投料时二氧化碳转化率的情况。
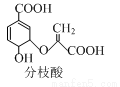


 mol-1
mol-1