题目内容
元素X基态原子的最外层有3个未成对电子,次外层有2个电子,含这种元素的阴离子可能是( )A.XO32-
B.XO3-
C.XO42-
D.XO4-
【答案】分析:基态原子的核外电子排布应为ns2np3,次外层有2个电子,其电子排布式为:1s22s22p3,应为N元素.
解答:解:基态原子的核外电子排布应为ns2np3,次外层有2个电子,其电子排布式为:1s22s22p3,应为N元素氮元素的最高正价是+5价.
A.氮元素无+4价的酸,故A错误;
B.XO3-的化合价为+5价,故B正确;
C.XO42-的化合价为+6价,故C错误;
D.XO4-的化合价为+7价,故D错误.
故选B.
点评:本题考查原子结构与元素关系、元素的性质等,难度不大,推断元素是关键.
解答:解:基态原子的核外电子排布应为ns2np3,次外层有2个电子,其电子排布式为:1s22s22p3,应为N元素氮元素的最高正价是+5价.
A.氮元素无+4价的酸,故A错误;
B.XO3-的化合价为+5价,故B正确;
C.XO42-的化合价为+6价,故C错误;
D.XO4-的化合价为+7价,故D错误.
故选B.
点评:本题考查原子结构与元素关系、元素的性质等,难度不大,推断元素是关键.

练习册系列答案
 应用题天天练四川大学出版社系列答案
应用题天天练四川大学出版社系列答案
相关题目
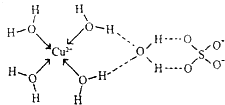 第四周期元素的单质及化合物在工农业生产中应用广泛.
第四周期元素的单质及化合物在工农业生产中应用广泛.
 键的数目之比为
。
键的数目之比为
。