题目内容
(2010?合肥三模)以下是一些元素的信ο,其中有一种元素不在短周期.根据信ο完成问题:
(1)写出A元素基态原子的核外电子排布式
(2)B、C、X的简单离子半径由大到小的顺序为
(3)化合物YZ4B化学键的类型是
(4)A元素的单质在潮湿空气中锈蚀生成绿色物质,用一个化学方程式表示锈蚀过程
(5)常温下,工业上用惰性电极在电解槽中电解100L 1.5mol?L-1CB的水溶液时,两极共收集到气体22.4L(标准状况下),计算电解后阴极区溶液的pH=
| 元素A | 元素B | 元素C | 元素X | 元素Y | 元素Z |
| 单质是一种常见金属,与元素X形成黑色和砖红色两种化合物 | 单质是一种黄绿色气体 | 短周期中金属性最强,与X反应能生成两种化合物 | 最外层电子数是内层电子数的3倍,能形成双原子阴离子 | 单质为双原子分子,结构中σ键与π键数目比为1:2 | 阳离子就是一个质子 |
1s22s22p63s23p63d104s1或[Ar]3d104s1
1s22s22p63s23p63d104s1或[Ar]3d104s1
.(2)B、C、X的简单离子半径由大到小的顺序为
Cl->O2->Na+
Cl->O2->Na+
(用元素离子符号表示).(3)化合物YZ4B化学键的类型是
离子键和共价键
离子键和共价键
,检验该固体化合物中阳离子的实验的方法和现象是取少量固体于试管中,加入浓NaOH溶液并加热,用湿润的红色石蕊试纸放在试管口,红色石蕊试纸变蓝
取少量固体于试管中,加入浓NaOH溶液并加热,用湿润的红色石蕊试纸放在试管口,红色石蕊试纸变蓝
.(4)A元素的单质在潮湿空气中锈蚀生成绿色物质,用一个化学方程式表示锈蚀过程
2Cu+O2+CO2+H2O═Cu2(OH)2CO3
2Cu+O2+CO2+H2O═Cu2(OH)2CO3
.(5)常温下,工业上用惰性电极在电解槽中电解100L 1.5mol?L-1CB的水溶液时,两极共收集到气体22.4L(标准状况下),计算电解后阴极区溶液的pH=
12
12
(假设电解前后溶液体积不变).分析:元素A的单质是一种常见金属,与元素X形成黑色和砖红色两种化合物,则A为Fe;元素B的单质是一种黄绿色气体,则B为Cl;元素C的短周期中金属性最强,与X反应能生成两种化合物,则C为Na;元素X的最外层电子数是内层电子数的3倍,能形成双原子阴离子,X为O;元素Y的单质为双原子分子,结构中σ键与π键数目比为1:2,Y为N;元素Z的阳离子就是一个质子,则Z为H.
(1)Fe的原子序数为26;
(2)电子层越多,离子半径越大,具有相同电子排布的离子,原子序数大的离子半径小;
(3)化合物YZ4B为NH4Cl;利用铵盐与碱反应生成氨气及氨气的检验来检验铵根离子;
(4)根据反应物与生成物来书写化学反应方程式;
(5)惰性电极电解NaCl溶液,阳极生成氯气,阴极生成氢气,由2H++2e-═H2↑来计算.
(1)Fe的原子序数为26;
(2)电子层越多,离子半径越大,具有相同电子排布的离子,原子序数大的离子半径小;
(3)化合物YZ4B为NH4Cl;利用铵盐与碱反应生成氨气及氨气的检验来检验铵根离子;
(4)根据反应物与生成物来书写化学反应方程式;
(5)惰性电极电解NaCl溶液,阳极生成氯气,阴极生成氢气,由2H++2e-═H2↑来计算.
解答:解:元素A的单质是一种常见金属,与元素X形成黑色和砖红色两种化合物,则A为Fe;元素B的单质是一种黄绿色气体,则B为Cl;元素C的短周期中金属性最强,与X反应能生成两种化合物,则C为Na;元素X的最外层电子数是内层电子数的3倍,能形成双原子阴离子,X为O;元素Y的单质为双原子分子,结构中σ键与π键数目比为1:2,Y为N;元素Z的阳离子就是一个质子,则Z为H.
(1)Fe的原子序数为26,其电子排布式为1s22s22p63s23p63d104s1或[Ar]3d104s1,
故答案为:1s22s22p63s23p63d104s1或[Ar]3d104s1;
(2)电子层越多,离子半径越大,具有相同电子排布的离子,原子序数大的离子半径小,则氯离子半径最大,钠离子与氧离子具有相同电子排布,则氧离子半径大,所以离子半径为Cl->O2->Na+,故答案为:Cl->O2->Na+;
(3)化合物YZ4B为NH4Cl,氯离子与铵根离子以离子键结合,N、H之间以共价键结合,则含有离子键和共价键;取少量固体于试管中,加入浓NaOH溶液并加热,用湿润的红色石蕊试纸放在试管口,红色石蕊试纸变蓝,则证明原固体中存在铵根离子,
故答案为:离子键和共价键;取少量固体于试管中,加入浓NaOH溶液并加热,用湿润的红色石蕊试纸放在试管口,红色石蕊试纸变蓝;
(4)反应物为铜、氧气、水、二氧化碳,生成物为Cu2(OH)2CO3,
则化学反应方程式为2Cu+O2+CO2+H2O═Cu2(OH)2CO3,故答案为:2Cu+O2+CO2+H2O═Cu2(OH)2CO3;
(5)惰性电极电解NaCl溶液,阳极生成氯气,阴极生成氢气,两极共收集到气体22.4L(标准状况下),
则氢气为11.2L,由2H++2e-═H2↑可知,n(H+)=n(OH-)=1mol,
所以c(OH-)=
=0.01mol/L,即pH=12,故答案为:12.
(1)Fe的原子序数为26,其电子排布式为1s22s22p63s23p63d104s1或[Ar]3d104s1,
故答案为:1s22s22p63s23p63d104s1或[Ar]3d104s1;
(2)电子层越多,离子半径越大,具有相同电子排布的离子,原子序数大的离子半径小,则氯离子半径最大,钠离子与氧离子具有相同电子排布,则氧离子半径大,所以离子半径为Cl->O2->Na+,故答案为:Cl->O2->Na+;
(3)化合物YZ4B为NH4Cl,氯离子与铵根离子以离子键结合,N、H之间以共价键结合,则含有离子键和共价键;取少量固体于试管中,加入浓NaOH溶液并加热,用湿润的红色石蕊试纸放在试管口,红色石蕊试纸变蓝,则证明原固体中存在铵根离子,
故答案为:离子键和共价键;取少量固体于试管中,加入浓NaOH溶液并加热,用湿润的红色石蕊试纸放在试管口,红色石蕊试纸变蓝;
(4)反应物为铜、氧气、水、二氧化碳,生成物为Cu2(OH)2CO3,
则化学反应方程式为2Cu+O2+CO2+H2O═Cu2(OH)2CO3,故答案为:2Cu+O2+CO2+H2O═Cu2(OH)2CO3;
(5)惰性电极电解NaCl溶液,阳极生成氯气,阴极生成氢气,两极共收集到气体22.4L(标准状况下),
则氢气为11.2L,由2H++2e-═H2↑可知,n(H+)=n(OH-)=1mol,
所以c(OH-)=
| 1mol |
| 100L |
点评:本题考查原结构与元素周期律,元素的推断是解答本题的关键,并熟悉元素化合物知识来解答,题目难度不大.

练习册系列答案
 第1卷单元月考期中期末系列答案
第1卷单元月考期中期末系列答案
相关题目
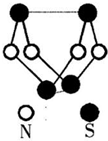 (2010?合肥三模)现代无机化学对硫一氮化合物的研究是最为活跃的领域之一.其中图是已经合成的最著名的硫一氮化合物的分子结构.下列说法错误的是( )
(2010?合肥三模)现代无机化学对硫一氮化合物的研究是最为活跃的领域之一.其中图是已经合成的最著名的硫一氮化合物的分子结构.下列说法错误的是( )
 (2010?合肥三模)在一密闭容器中充入4mol SO2和一定量O2,发生反应:2SO2(g)+O2(g)?2SO3(g)△H=一196.6kJ?mol-1.则下列说法正确的是( )
(2010?合肥三模)在一密闭容器中充入4mol SO2和一定量O2,发生反应:2SO2(g)+O2(g)?2SO3(g)△H=一196.6kJ?mol-1.则下列说法正确的是( )