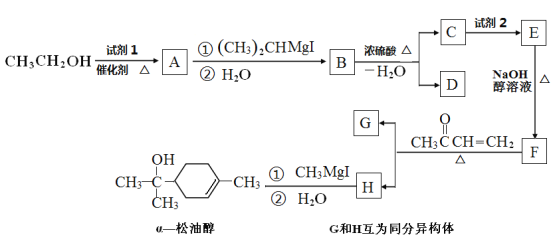
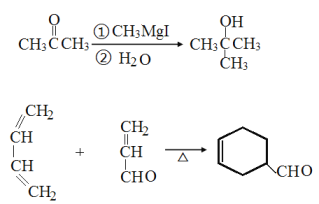
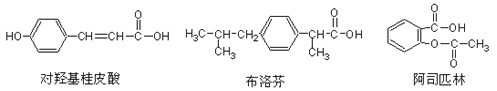
题目内容
【题目】为探究原电池和电解池的工作原理,某研究性小组分别用如图所示装置进行实验。
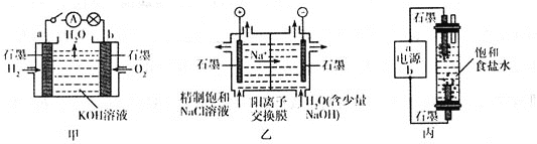
(1)甲装置中,a电极的反应式为________________________________________。
(2)乙装置中,阴极区产物为_________________________。
(3)丙装置是一种家用环保型消毒液发生器。外接电源a为_____________(填“正”或“负”)极,该装置内发生反应的化学方程式为___________________________________________________________________。
(4)若甲装置作为乙装置的电源,一段时间后,甲中消耗气体与乙中产生气体的物质的量之比为____________(不考虑气体的溶解)。
【答案】H2-2e-+2OH-=2H2O氢氧化钠和氢气负2NaCl+2H2O![]() 2NaOH+H2↑+Cl2↑,Cl2+2NaOH=NaCl+NaClO+H2O3:4
2NaOH+H2↑+Cl2↑,Cl2+2NaOH=NaCl+NaClO+H2O3:4
【解析】
(1)甲装置中,a电极通入的是氢气,因此a电极是负极,发生氧化反应。(2)乙装置是电解饱和食盐水,阴极是溶液中的氢离子放电产生氢气,同时使水的电离平衡正向移动,从而产生氢氧根离子;(3)丙装置是一种家用环保型消毒液发生器,电解饱和食盐水生成氢氧化钠和氯气、氢气,氯气和氢氧化钠反应生成具有消毒作用的次氯酸钠,为使氯气与氢氧化钠充分反应,下端电极生成氯气,所以电源a为负极。
(4)若甲装置作为乙装置的电源,因此满足电子转移守恒。每消耗2mol氢气同时消耗1mol氧气,转移4mol电子。而在乙装置中可以产生2mol氢气和2mol氯气,所以一段时间后,甲中消耗气体与乙中产生气体的物质的量之比为3:4。
(1)甲装置是氢氧燃料电池,a电极通入的是氢气,a电极是负极,电极反应式为H2-2e-+2OH-=2H2O;
(2)乙装置是电解饱和食盐水,阴极是溶液中的氢离子放电产生氢气,同时使水的电离平衡正向移动,从而产生氢氧根离子,钠离子向阴极运动,所以阴极区产物为NaOH和H2;
(3)丙装置是一种家用环保型消毒液发生器,电解饱和食盐水生成氢氧化钠和氯气、氢气,氯气和氢氧化钠反应生成具有消毒作用的次氯酸钠,为使氯气与氢氧化钠充分反应,下端电极生成氯气,所以电源a为负极,该装置内发生反应的化学方程式为2NaCl+2H2O![]() 2NaOH+H2↑+Cl2↑,Cl2+2NaOH=NaCl+NaClO+H2O;
2NaOH+H2↑+Cl2↑,Cl2+2NaOH=NaCl+NaClO+H2O;
(4)若甲装置作为乙装置的电源,因此满足电子转移守恒。每消耗2mol氢气同时消耗1mol氧气,转移4mol电子。而在乙装置中可以产生2mol氢气和2mol氯气,所以一段时间后,甲中消耗气体与乙中产生气体的物质的量之比为3:4。

 口算题天天练系列答案
口算题天天练系列答案