题目内容
将5.500g铁铝混合物粉末加入900.00mL 1.00mol/L HNO3溶液中,充分反应后,得a L(标准状况)NO气体.(要求带计算过程)
(1)HNO3是否过量 .
(2)若a=3.360L(标准状况),则混合物中铝的质量分数为 %.
(3)若a=3.360L(标准状况),往反应后的溶液中加入 mL 1.000mol/L NaOH溶液时生成的沉淀量最大,还要加 mL 1.000mol/L NaOH溶液才能使沉淀的量保持不变.
(1)HNO3是否过量
(2)若a=3.360L(标准状况),则混合物中铝的质量分数为
(3)若a=3.360L(标准状况),往反应后的溶液中加入
考点:化学方程式的有关计算
专题:计算题
分析:(1)同质量的铝消耗硝酸的量多,如果5.500g金属全部是铝,需要硝酸
×4=0.8<0.9,所硝酸过量;
(2)可根据质量守恒和电子守恒的关系式;
(3)用终态思想沉淀量最大,最后得到的溶液是硝酸钠单一的溶液,由硝酸根离子求钠离子.
| 5.5g |
| 27g/mol |
(2)可根据质量守恒和电子守恒的关系式;
(3)用终态思想沉淀量最大,最后得到的溶液是硝酸钠单一的溶液,由硝酸根离子求钠离子.
解答:
解:(1)同质量的铝消耗硝酸的量多,如果5.500g金属全部是铝,需要硝酸
×4=0.8<0.9,所硝酸过量,故答案为:是;
(2)设铝铁的物质的量分别为:xmol、ymol,根据质量守恒得27x+56y=5.5;得失电子守恒得(硝酸过量铁变成三价铁):3x+3y=
×3,由两式解得:x=0.1mol;y=0.05mol,所以铝的质量分数为:
×100%=49.09%,故答案为:49.09;
(3)沉淀量最大,最后得到的溶液是硝酸钠单一的溶液,所以n(NaOH)=0.9-0.15=0.75mol,V=
=750 mL,
由Al~~Al(OH)3~~OH-关系可知:
0.1mol 0.1mol
使沉淀的量保持不变还需的体积为:
=100ml,
故答案为:750;100.
| 5.5g |
| 27g/mol |
(2)设铝铁的物质的量分别为:xmol、ymol,根据质量守恒得27x+56y=5.5;得失电子守恒得(硝酸过量铁变成三价铁):3x+3y=
| 3.360L |
| 22.4L/mol |
| 0.1×27 |
| 5.5 |
(3)沉淀量最大,最后得到的溶液是硝酸钠单一的溶液,所以n(NaOH)=0.9-0.15=0.75mol,V=
| 0.75mol |
| 1.000mol/L |
由Al~~Al(OH)3~~OH-关系可知:
0.1mol 0.1mol
使沉淀的量保持不变还需的体积为:
| 0.1mol |
| 1.00mol/L |
故答案为:750;100.
点评:这是关于混合物的计算的典型题,还有过量问题、极端思考、终态思考,注意守恒关系的应用.

练习册系列答案
相关题目
把A、B、C、D四块金属泡在稀H2SO4中,用导线两两相连可以组成各种原电池.A、B相连时,A为负极;C、D相连时,电流由D→导线→C;A、C相连时,A极减轻;B、D相连时,D极发生氧化反应.则四种金属的活动性顺序由大到小排列为( )
| A、A>B>C>D |
| B、A>C>B>D |
| C、A>C>D>B |
| D、B>D>C>A |
 mA(s)+nB(g)?qC(g);△H<0的可逆反应,在一定温度下的密闭容器中进行,平衡时B的体积分数V(B)%与压强(P)关系如下图所示,下列叙述不正确的是( )
mA(s)+nB(g)?qC(g);△H<0的可逆反应,在一定温度下的密闭容器中进行,平衡时B的体积分数V(B)%与压强(P)关系如下图所示,下列叙述不正确的是( )| A、m+n<q |
| B、n>q |
| C、X点时的状态,V正>V逆 |
| D、X点比Y点混和物的正反应速率快 |

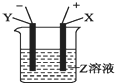 根据如图所示装置回答:
根据如图所示装置回答: