题目内容
17.下列物质中不容易分解的是( )| A. | Fe(OH)3 | B. | NaOH | C. | HClO | D. | NaHCO3 |
分析 A、氢氧化铁受热分解生成氧化铁和水;
B、氢氧化钠受热不分解;
C、次氯酸光照或加热分解生成盐酸和氧气;
D、碳酸氢钠受热分解生成碳酸钠、二氧化碳和水.
解答 解:A、氢氧化铁受热分解生成氧化铁和水,容易分解,2Fe(OH)3$\frac{\underline{\;\;△\;\;}}{\;}$Fe2O3+3H2O,故A错误;
B、氢氧化钠是溶于水的强碱受热不分解,故B正确;
C、次氯酸光照或加热分解生成盐酸和氧气,2HClO$\frac{\underline{\;光照\;}}{\;}$2HCl+O2↑,故C错误;
D、碳酸氢钠受热分解生成碳酸钠、二氧化碳和水,2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+CO2↑+H2O,故D错误;
故选B.
点评 本题考查了物质性质的分析应用,主要是化合物受热分解的条件和产物判断,主要是酸碱盐的性质应用,掌握基础是关键,题目较简单.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
7.下列表示可燃物燃烧热的热化学方程式书写正确的是( )
| A. | P4(白磷、s)+3O2(g)═2P2O3(s)△H=-1638 kJ/mol | |
| B. | CH4(g)+2O2(g)═CO2(g)+2H2O(g)△H=-802.3 kJ/mol | |
| C. | 2CO(g)+O2(g)═2CO2(g)△H=-566 kJ/mol | |
| D. | H2(g)+1/2O2(g)═H2O(l)△H=-285.8 kJ/mol |
8.用CH3CO18OH和CH3H2OH发生酯化反应,对于18O的说法正确的是( )
| A. | 18O存在于乙酸、乙酸乙酯和水中 | B. | 18O只存在于乙醇中 | ||
| C. | 18O只存在于乙酸和水中 | D. | 18O存在于水中 |
5.下列物质的转化在指定条件下能实现的是( )
| A. | Al2O3$→_{△}^{NaOH(aq)}$NaAlO2(aq)$\stackrel{CO_{2}}{→}$Al(OH)3 | |
| B. | 饱和NaCl(aq)$\stackrel{NH_{3},CO_{2}}{→}$Na2CO3 | |
| C. | Fe2O3$\stackrel{HCl(aq)}{→}$FeCl3(aq)$\stackrel{△}{→}$无水FeCl3 | |
| D. | MgCl2(aq)$\stackrel{石灰乳}{→}$Mg(OH)2$\stackrel{煅烧}{→}$MgO |
12.下列有关钢铁的腐蚀与防护的说法正确的是( )
| A. | 钢铁发生析氢腐蚀时,负极反应是Fe-3e-=Fe3+ | |
| B. | 钢铁发生析氧腐蚀的时候正极反应是2H2O+O2+e-═4OH- | |
| C. | 钢管与电源负极相连时,钢管可被保护 | |
| D. | 在入海口的钢铁闸门上装一定数量的铜块,可防止闸门被腐蚀 |
9.下列物质中,既存在离子键又存在非极性键的是( )
| A. | H2O2 | B. | MgCl2 | C. | CaC2 | D. | NaOH |
6.下述实验不能能达到预期目的是( )
| 实验内容 | 实验目的 | |
| A | 向碳酸钠溶液中滴入几滴酚酞溶液 | 证明碳酸钠溶液呈碱性 |
| B | 取少量未知溶液于一只干净的试管中,向该溶液中逐渐滴入NaOH溶液直至过量 | 检验该溶液中是否含有Al3+ |
| C | 取未知溶液做焰色反应实验,并通过蓝色钴玻璃观看 | 检验该溶液中是否含有K+ |
| D | 取少量未知溶液,滴加新制的氯水,再滴加KSCN溶液 | 检验未知液中是否含Fe2+ |
| A. | A | B. | B | C. | C | D. | D |
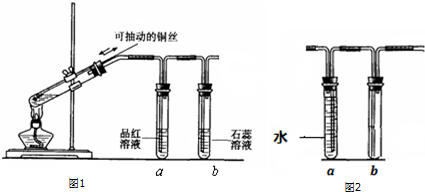 几位同学设计实验观察铜与浓硫酸的反应,检验生成的气体的性质.甲设
几位同学设计实验观察铜与浓硫酸的反应,检验生成的气体的性质.甲设