题目内容
今有A、B、C、D四种元素,已知A元素是地壳中含量最多的元素;B元素为金属元素,它的原子核外K、L层上电子数之和等于M、N层电子数之和;C元素是第3周期第一电离能最小的元素,D元素在第3周期中电负性最大.
(1)试推断A、B、C、D四种元素的符号:
A
(2)写出A元素原子的核外电子排布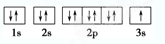
 ;
;
(3)比较四种元素的第一电离能和电负性的大小:第一电离能
(1)试推断A、B、C、D四种元素的符号:
A
O
O
、BCa
Ca
、CNa
Na
、DCl
Cl
.(2)写出A元素原子的核外电子排布
1s22s22p4
1s22s22p4
;写出B元素原子核外电子排布的价电子4s2
4s2
;用轨道表示式表示C原子的核外电子排布情况

(3)比较四种元素的第一电离能和电负性的大小:第一电离能
Na<Ca<Cl<O
Na<Ca<Cl<O
;电负性Na<Ca<Cl<O
Na<Ca<Cl<O
.分析:A、B、C、D四种元素,已知A元素是地壳中含量最多的元素则A是O元素;B元素为金属元素,它的原子核外K、L层上电子数之和等于M、N层电子数之和,则B是Ca元素;C元素是第3周期第一电离能最小的元素,则C是Na元素,D元素在第3周期中电负性最大,则D是Cl元素.
解答:解:A、B、C、D四种元素,已知A元素是地壳中含量最多的元素则A是O元素;B元素为金属元素,它的原子核外K、L层上电子数之和等于M、N层电子数之和,则B是Ca元素;C元素是第3周期第一电离能最小的元素,则C是Na元素,D元素在第3周期中电负性最大,则D是Cl元素.
(1)通过以上分析知,A、B、C、D四种元素分别是O、Ca、Na、Cl,故答案为:O;Ca;Na;Cl;
(2)A元素核外有8个电子,根据构造原理知,A元素原子的核外电子排布1s22s22p4,B元素核外有20个电子,其价电子是第四周期4s能级上电子有两个,所以B元素原子核外电子排布的价电子为4s2;C元素核外有11个电子,有1s 2s 2p 3s四个能级,其轨道表示式为: ,
,
故答案为:1s22s22p4;4s2; ;
;
(3)元素的非金属性越强,其电负性越强,同一周期中,元素的第一电离能随着原子序数的增大而呈增大趋势,但第IIA族和第VA族元素大于其相邻元素,元素的非金属性越强,其第一电离能越大,所以第一电离能大小顺序是Na<Ca<Cl<O,电负性大小顺序是Na<Ca<Cl<O,
故答案为:Na<Ca<Cl<O;Na<Ca<Cl<O.
(1)通过以上分析知,A、B、C、D四种元素分别是O、Ca、Na、Cl,故答案为:O;Ca;Na;Cl;
(2)A元素核外有8个电子,根据构造原理知,A元素原子的核外电子排布1s22s22p4,B元素核外有20个电子,其价电子是第四周期4s能级上电子有两个,所以B元素原子核外电子排布的价电子为4s2;C元素核外有11个电子,有1s 2s 2p 3s四个能级,其轨道表示式为:
 ,
,故答案为:1s22s22p4;4s2;
 ;
;(3)元素的非金属性越强,其电负性越强,同一周期中,元素的第一电离能随着原子序数的增大而呈增大趋势,但第IIA族和第VA族元素大于其相邻元素,元素的非金属性越强,其第一电离能越大,所以第一电离能大小顺序是Na<Ca<Cl<O,电负性大小顺序是Na<Ca<Cl<O,
故答案为:Na<Ca<Cl<O;Na<Ca<Cl<O.
点评:本题考查了元素电负性、第一电离能大小的判断、核外电子排布式的书写等知识点,注意元素周期律中的异常现象,难度不大.

练习册系列答案
相关题目


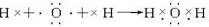



 NH4++OH-,试判断溶于水后,形成的合理结构是________。(填右图中的字母)
NH4++OH-,试判断溶于水后,形成的合理结构是________。(填右图中的字母) 