题目内容
某工厂的废金属屑中主要成分为Cu、Fe和Al,此外还含有少量Al2O3和Fe2O3,该厂用上述废金属屑制取新型高效水处理剂Na2FeO4(高铁酸钠)等产品,过程如下:
I.向废金属屑中加入过量的NaOH溶液,充分反应后过滤;
II.向I所得固体中加入过量稀H2SO4,充分反应后过滤;
III.向II所得固体中继续加入热的稀H2SO4,同时不断鼓入空气,固体溶解得CuSO4溶液;
IV.(1)步骤I中发生反应的化学方程式为 、 。
(2)步骤II所得的滤液中加入KSCN溶液无明显现象,表明滤液中不存在Fe3+,用离子方程式解释其
可能的原因 。
(3)步骤III获得CuSO4溶液的离子方程式为 。
(4)步骤II所得滤液经进一步处理可制得Na2FeO4,流程如下:

①测得滤液中c(Fe2+) 为a mol·L-1,若要处理1 m3滤液,理论上需要消耗25 % 的H2O2溶液_________kg
(用含a的代数式表示)。
②写出由Fe(OH)3制取Na2FeO4的化学方程式___________。
I.向废金属屑中加入过量的NaOH溶液,充分反应后过滤;
II.向I所得固体中加入过量稀H2SO4,充分反应后过滤;
III.向II所得固体中继续加入热的稀H2SO4,同时不断鼓入空气,固体溶解得CuSO4溶液;
IV.(1)步骤I中发生反应的化学方程式为 、 。
(2)步骤II所得的滤液中加入KSCN溶液无明显现象,表明滤液中不存在Fe3+,用离子方程式解释其
可能的原因 。
(3)步骤III获得CuSO4溶液的离子方程式为 。
(4)步骤II所得滤液经进一步处理可制得Na2FeO4,流程如下:

①测得滤液中c(Fe2+) 为a mol·L-1,若要处理1 m3滤液,理论上需要消耗25 % 的H2O2溶液_________kg
(用含a的代数式表示)。
②写出由Fe(OH)3制取Na2FeO4的化学方程式___________。
(1)2Al+2H2O+2NaOH=2NaAlO2+3H2↑(2分)
Al2O3+2NaOH=2NaAlO2+H2O(2分)
(2) 2Fe3++Fe=3Fe2+ (或2Fe3++Cu=2Fe2++Cu2+或Fe+Fe2O3+6H+=3Fe2++3 H2O等)(1分)
(3)2Cu+O2+4H+ 2Cu2++2H2O(2分)
2Cu2++2H2O(2分)
(4) ① 68 a(2分)
②2Fe(OH)3+3NaClO+4NaOH=2Na2FeO4+3NaCl+5H2O (2分)
Al2O3+2NaOH=2NaAlO2+H2O(2分)
(2) 2Fe3++Fe=3Fe2+ (或2Fe3++Cu=2Fe2++Cu2+或Fe+Fe2O3+6H+=3Fe2++3 H2O等)(1分)
(3)2Cu+O2+4H+
 2Cu2++2H2O(2分)
2Cu2++2H2O(2分)(4) ① 68 a(2分)
②2Fe(OH)3+3NaClO+4NaOH=2Na2FeO4+3NaCl+5H2O (2分)
试题分析:(1)废金属屑中能和氢氧化钠溶液反应的物质是金属铝和两性氧化物氧化铝,所以反应的化学方程式为2Al+2H2O+2NaOH=2NaAlO2+3H2↑、Al2O3+2NaOH=2NaAlO2+H2O。
(2)I所得固体中含有铁、铜和氧化铁,加入过量稀H2SO4后铁、氧化铁被溶解分别生成硫酸亚铁和硫酸铁。由于铁离子具有氧化性,能氧化单质铜生成铜离子和亚铜离子,所以加入KSCN溶液后不显红色,反应的离子方程式为2Fe3++Fe=3Fe2+。
(3)铜与稀硫酸不反应,但在加热的条件下能被空气中的氧气氧化生成氧化铜,氧化铜可以溶解在稀硫酸中生成硫酸铜,反应的化学方程式为2Cu+O2+4H+
 2Cu2++2H2O。
2Cu2++2H2O。(4)①滤液中亚铁离子的物质的量是1000amol,生成氢氧化铁失去1000amol电子。双氧水在反应中氧元素的化合价从-1价降低到-2价,得到1个电子,因此1mol双氧水在反应中得到2mol电子。设需要双氧水溶液的质量是m,则根据电子得失守恒可知,
 ×2=1000amol,解得m=68000amg=68amkg。
×2=1000amol,解得m=68000amg=68amkg。②铁元素的化合价从+3价升高到+6价失去3个电子,次氯酸钠中氯元素的化合价从+1价降低到-1 价,得到2个电子。因此根据电子得失守恒可知还原剂与氧化剂的物质的量之比=2:3。根据原子守恒可知,反应中还有水生成,所以反应的化学方程式为2Fe(OH)3+3NaClO+4NaOH=2Na2FeO4+3NaCl+5H2O。

练习册系列答案
相关题目
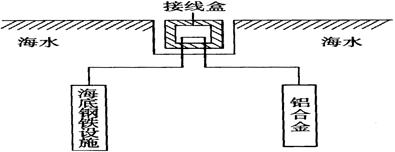



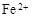 和
和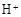 外,还可能存在 (用离子符号表示),检测该离子的方法是 。
外,还可能存在 (用离子符号表示),检测该离子的方法是 。