题目内容
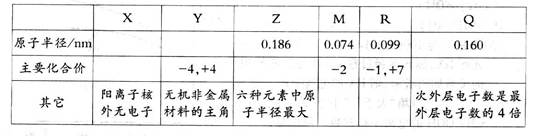
有x、Y、Z、M、R、Q六种短周期主族元素,部分信息如下表所示:
请回答下列问题:
(1)R在元素周期表中的位置是
(2)根据表中数据推测,Y的原子半径的最小范围是
(3)Z、M、Q的简单离子的离子半径的大小顺序为
(4)Y与R相比,非金属性较强的是
a.常温下Y的单质呈固态,R的单质呈气态
b.稳定性XR>YX.
c.Y与R形成的化合物中Y呈正价
(5)X、M、Z三种元素组成的化合物中含有的化学键为
| X | Y | Z | M | R | Q | |
| 原子半径/nm | 0.186 | 0.074 | 0.099 | 0.160 | ||
| 主要化合价 | -4,+4 | -2 | -1,+7 | |||
| 其它 | 阳离子核外无电子 | 无机非金属材料的主角 | 六种元素中原子半径最大 | 次外层电子数是最外层电子数的4倍 |
(1)R在元素周期表中的位置是
第三周期ⅦA族
第三周期ⅦA族
.(2)根据表中数据推测,Y的原子半径的最小范围是
大于0.099nm,小于0.160nm
大于0.099nm,小于0.160nm
.(3)Z、M、Q的简单离子的离子半径的大小顺序为
O2>Na+>Mg2+
O2>Na+>Mg2+
(用元素符号表示).(4)Y与R相比,非金属性较强的是
Cl
Cl
(用元素符号表示),下列事实能证明这一结论的是bc
bc
(选填字母序号).a.常温下Y的单质呈固态,R的单质呈气态
b.稳定性XR>YX.
c.Y与R形成的化合物中Y呈正价
(5)X、M、Z三种元素组成的化合物中含有的化学键为
离子键、共价键
离子键、共价键
;写出R的单质与上述化合物的水溶液反应的离子方程式:Cl2+2OH=Cl-+ClO-+H2O
Cl2+2OH=Cl-+ClO-+H2O
.分析:X、Y、Z、M、R、Q六种短周期主族元素,X阳离子核外无电子,则X为氢元素;Y有-4、+4价,处于ⅣA族,是无机非金属材料的主角,则Y为Si元素;R有+7、-1价,处于ⅦA族,R为Cl元素;M有-2价,处于ⅥA族,原子半径小于Cl原子,则M为氧元素;Q次外层电子数是最外层电子数的4倍,Q有3个电子层,最外层电子数为2,则Q为Mg元素;Z在六种元素中原子半径最大,则Z为Na元素,据此解答.
解答:解:X、Y、Z、M、R、Q六种短周期主族元素,X阳离子核外无电子,则X为氢元素;Y有-4、+4价,处于ⅣA族,是无机非金属材料的主角,则Y为Si元素;R有+7、-1价,处于ⅦA族,R为Cl元素;M有-2价,处于ⅥA族,原子半径小于Cl原子,则M为氧元素;Q次外层电子数是最外层电子数的4倍,Q有3个电子层,最外层电子数为2,则Q为Mg元素;Z在六种元素中原子半径最大,则Z为Na元素,
(1)R为Cl元素,原子核外有3个电子层,最外层电子数为7,处于周期表中第三周期ⅦA族,故答案为:第三周期ⅦA族;
(2)同周期自左而右原子半径减小,Si的原子半径介于Mg以Cl原子半径之间,故Si的原子半径的最小范围是 大于0.099nm,小于0.160nm,
故答案为:大于0.099nm,小于0.160nm;
(3)O2、Na+、Mg2+电子层结构相同,核电荷数越大离子半径越小,故离子半径的大小顺序为O2>Na+>Mg2+,
故答案为:O2>Na+>Mg2+;
(4)同周期自左而右非金属性增强,故非金属性Cl>Si,
a.物质的聚集状态属于物理性质,不能说明非金属性强弱,故a错误;
b.氢化物越稳定,中心元素的非金属性越强,稳定性HCl>SiH4,说明非金属性Cl>Si,故b正确;
c.Si与Cl形成的化合物中Si呈正价,说明Cl吸引电子的能力强,Cl元素的非金属性更强,故c正确;
故答案为:Cl;bc;
(5)X、M、Z三种元素组成的化合物是NaOH,含有离子键、共价键;氯气与氢氧化钠溶液反应生成氯化钠、次氯酸钠、水,反应离子方程式为Cl2+2OH=Cl-+ClO-+H2O,
故答案为:离子键、共价键;Cl2+2OH=Cl-+ClO-+H2O.
(1)R为Cl元素,原子核外有3个电子层,最外层电子数为7,处于周期表中第三周期ⅦA族,故答案为:第三周期ⅦA族;
(2)同周期自左而右原子半径减小,Si的原子半径介于Mg以Cl原子半径之间,故Si的原子半径的最小范围是 大于0.099nm,小于0.160nm,
故答案为:大于0.099nm,小于0.160nm;
(3)O2、Na+、Mg2+电子层结构相同,核电荷数越大离子半径越小,故离子半径的大小顺序为O2>Na+>Mg2+,
故答案为:O2>Na+>Mg2+;
(4)同周期自左而右非金属性增强,故非金属性Cl>Si,
a.物质的聚集状态属于物理性质,不能说明非金属性强弱,故a错误;
b.氢化物越稳定,中心元素的非金属性越强,稳定性HCl>SiH4,说明非金属性Cl>Si,故b正确;
c.Si与Cl形成的化合物中Si呈正价,说明Cl吸引电子的能力强,Cl元素的非金属性更强,故c正确;
故答案为:Cl;bc;
(5)X、M、Z三种元素组成的化合物是NaOH,含有离子键、共价键;氯气与氢氧化钠溶液反应生成氯化钠、次氯酸钠、水,反应离子方程式为Cl2+2OH=Cl-+ClO-+H2O,
故答案为:离子键、共价键;Cl2+2OH=Cl-+ClO-+H2O.
点评:本题考查结构性质位置关系、元素周期律等,难度不大,利用原子半径及化合价来推断出元素是解答本题的关键.

练习册系列答案
相关题目
有x、Y、Z、M、R、Q六种短周期主族元素,部分信息如下表所示:
请回答下列问题:
(1)R在元素周期表中的位置是______.
(2)根据表中数据推测,Y的原子半径的最小范围是______.
(3)Z、M、Q的简单离子的离子半径的大小顺序为______ (用元素符号表示).
(4)Y与R相比,非金属性较强的是______ (用元素符号表示),下列事实能证明这一结论的是______ (选填字母序号).
a.常温下Y的单质呈固态,R的单质呈气态
b.稳定性XR>YX.
c.Y与R形成的化合物中Y呈正价
(5)X、M、Z三种元素组成的化合物中含有的化学键为______;写出R的单质与上述化合物的水溶液反应的离子方程式:______.
| X | Y | Z | M | R | Q | |
| 原子半径/nm | 0.186 | 0.074 | 0.099 | 0.160 | ||
| 主要化合价 | -4,+4 | -2 | -1,+7 | |||
| 其它 | 阳离子核外无电子 | 无机非金属材料的主角 | 六种元素中原子半径最大 | 次外层电子数是最外层电子数的4倍 |
(1)R在元素周期表中的位置是______.
(2)根据表中数据推测,Y的原子半径的最小范围是______.
(3)Z、M、Q的简单离子的离子半径的大小顺序为______ (用元素符号表示).
(4)Y与R相比,非金属性较强的是______ (用元素符号表示),下列事实能证明这一结论的是______ (选填字母序号).
a.常温下Y的单质呈固态,R的单质呈气态
b.稳定性XR>YX.
c.Y与R形成的化合物中Y呈正价
(5)X、M、Z三种元素组成的化合物中含有的化学键为______;写出R的单质与上述化合物的水溶液反应的离子方程式:______.