题目内容
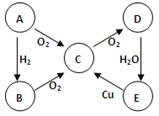
(10分)下图中每一方框中的字母代表一种反应物或生成物。已知:A、B、C、D均为前三周期元素的单质,也是中学化学教材中常见的物质。其中A、B为固体,且B是良好的半导体材料,C、D为气体,电解H的饱和溶液生成x、C和D,此反应是一个重要的化工反应(物质间相互转化时参加反应或生成的H2O已略去)
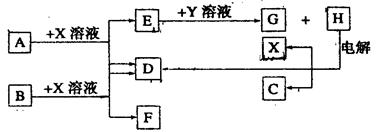
(1)B单质为 .列举B的氧化物的一种重要的工业用途为 。
(2)X的电子式为 ,Y是(填化学式) 。
(3)E和G在水溶液中混合反应,其离子反应方程式为
。
若在E的水溶液中通入过量的CO2,其离子反应方程式为
。
(4)25℃时用石墨电极电解含0.2 mol H的水溶液,在阳极产生0.2 mol气体时,测得此时溶液的体积为200 mL,则该溶液中C(OH-)最接近的数值为 。

(1)B单质为 .列举B的氧化物的一种重要的工业用途为 。
(2)X的电子式为 ,Y是(填化学式) 。
(3)E和G在水溶液中混合反应,其离子反应方程式为
。
若在E的水溶液中通入过量的CO2,其离子反应方程式为
。
(4)25℃时用石墨电极电解含0.2 mol H的水溶液,在阳极产生0.2 mol气体时,测得此时溶液的体积为200 mL,则该溶液中C(OH-)最接近的数值为 。
(1)Si 制造玻璃或光导纤维等 (2)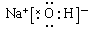 HCl
HCl
(3)3[Al(OH)4]-+Al3+===4Al(OH)3↓ Al(OH)4+CO2===Al(OH)3↓+HCO3- (4)1 mol
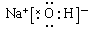 HCl
HCl(3)3[Al(OH)4]-+Al3+===4Al(OH)3↓ Al(OH)4+CO2===Al(OH)3↓+HCO3- (4)1 mol
本题是无机框图题,关键是找准突破点。B是良好的半导体材料,则B是硅。硅能和氢氧化钠溶液反应,生成硅酸钠和氢气,所以D是氢气,F是硅酸钠。电解H的饱和溶液生成x、C和D,说明H是氯化钠,所以C是氯气。A也能和氢氧化钠反应生成氢气,所以A是铝,E是偏铝酸钠偏铝酸钠和盐酸反应生成氯化钠和氯化铝,氯化铝和偏铝酸钠混合即生成氢氧化铝沉淀。
(1)二氧化硅的重要用途是制造玻璃或光导纤维等。
(2)氢氧化钠是离子化合物,电子式为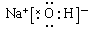 。
。
(3)如果CO2过量,则生成碳酸氢钠,所以方程式为Al(OH)4+CO2===Al(OH)3↓+HCO3-。
(4)阳极是氯离子放电,生成氯气,方程式为2NaCl+2H2O 2NaOH+H2↑+Cl2↑,由于氯化钠是0.2mol,只能生成0.1mol氯气和0.2mol氢氧化钠。这说明反应中还生成氢气。氢氧化钠的浓度是0.2mol÷0.2L=1.0mol/L。
2NaOH+H2↑+Cl2↑,由于氯化钠是0.2mol,只能生成0.1mol氯气和0.2mol氢氧化钠。这说明反应中还生成氢气。氢氧化钠的浓度是0.2mol÷0.2L=1.0mol/L。
(1)二氧化硅的重要用途是制造玻璃或光导纤维等。
(2)氢氧化钠是离子化合物,电子式为
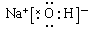 。
。(3)如果CO2过量,则生成碳酸氢钠,所以方程式为Al(OH)4+CO2===Al(OH)3↓+HCO3-。
(4)阳极是氯离子放电,生成氯气,方程式为2NaCl+2H2O
 2NaOH+H2↑+Cl2↑,由于氯化钠是0.2mol,只能生成0.1mol氯气和0.2mol氢氧化钠。这说明反应中还生成氢气。氢氧化钠的浓度是0.2mol÷0.2L=1.0mol/L。
2NaOH+H2↑+Cl2↑,由于氯化钠是0.2mol,只能生成0.1mol氯气和0.2mol氢氧化钠。这说明反应中还生成氢气。氢氧化钠的浓度是0.2mol÷0.2L=1.0mol/L。
练习册系列答案
相关题目