题目内容
【题目】实验题:
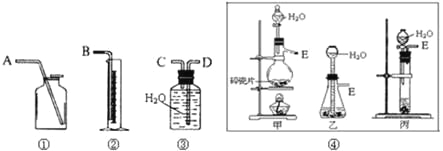
请从下图中选用必要的装置进行电解饱和食盐水的实验,要求测定产生的氢气的体积(大于25mL),并检验氯气的氧化性。
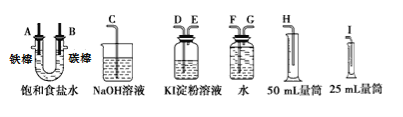
(1)A极发生的电极反应式是,B极发生的电极反应式是。
(2)设计上述气体实验装置时,各接口的正确连接顺序为:A接、接;B接、接。
(3)在实验中,盛有KI淀粉溶液的容器中发生反应的离子方程式为。
(4)已知饱和食盐水50mL(假设NaCl足量且忽略溶液体积变化),某时刻测得H2体积为16.8mL(标准状况)。此时溶液pH约为。(lg2=0.3,lg3=0.5,lg5=0.7)
(5)已知甲烷燃料电池采用铂为电极材料,两电极上分别通入CH4和O2,电解质为KOH溶液。某研究小组将甲烷燃料电池作为电源,进行上述饱和食盐水电解实验。若甲烷通入量为1L(标准状况),且反应完全,则理论上通过电解池的电量为(已知NA=6.02×1023mol-1,电子电荷为1.60×10-19C,列式表示即可)。
【答案】(1)2H++2e-=H2↑;2Cl--2e-=Cl2↑(2)G;F;H;D;E;C。
(3)Cl2+2I-=2Cl-+I24)12.5(5)![]() ×8×6.02×1023mol-1×1.60×10-19C
×8×6.02×1023mol-1×1.60×10-19C
【解析】
试题分析:(1)电解饱和食盐水时,溶液中的阳离子H+在阴极得到电子变为H2逸出,使附近的水溶液显碱性,溶液中的阴离子Cl-在阳极失去电子,发生氧化反应产生Cl2,A是铁,则A电极是阴极,电极反应式是2H++2e-=H2↑,B电极是阳极,电极反应式为2Cl--2e-=Cl2↑。(2)若电解饱和NaCl溶液来测定产生的H2的体积并检验Cl2的氧化性。则应该使A与电源的负极连接,作阴极,B作阳极,与电源的正极相连,则正确连接顺序为A→G→F→H;B→D→E→C;(3)氯气能把碘化钾氧化为单质碘,反应的离子方程式为Cl2+2I-=2Cl-+I2。(4)16.8mL氢气的物质的量是0.0168L÷22.4L/mol=0.00075mol,根据方程式2Cl-+2H2O![]() Cl2↑+H2↑+2OH-可知生成氢氧根的物质的量是0.0015mol,浓度是0.0015mol÷0.05L=0.03mol/L,则氢离子浓度是
Cl2↑+H2↑+2OH-可知生成氢氧根的物质的量是0.0015mol,浓度是0.0015mol÷0.05L=0.03mol/L,则氢离子浓度是![]() ,所以pH=12.5;(5)根据电子得失守恒可知甲烷失去的电子的物质的量就是电解池中通过的,则理论上通过电解池的电量为
,所以pH=12.5;(5)根据电子得失守恒可知甲烷失去的电子的物质的量就是电解池中通过的,则理论上通过电解池的电量为![]() ×8×6.02×1023mol-1×1.60×10-19C。
×8×6.02×1023mol-1×1.60×10-19C。

【题目】下表中的实验操作能达到实验目的或能得出相应结论的是( )
选项 | 实验操作 | 实验目的或结论 |
A | 向含有少量FeCl3的MgCl2溶液中加入足量NaOH溶液,搅拌后静置过滤 | 除去MgCl2溶液中少量FeCl3 |
B |
| NaHCO3比Na2CO3受热更易分解 |
C |
| 制取并收集氨气 |
D | 将混有Ca(OH)2杂质的Mg(OH)2样品,放入水中搅拌成浆状后,加入足量饱和氯化镁溶液充分搅拌、过滤,沉淀用蒸馏水洗涤 | 除去Mg(OH)2样品中的Ca(OH)2 |