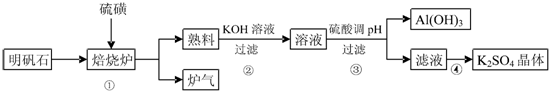
题目内容
13.已知3.25g某金属X跟过量稀硝酸反应,在反应过程中未见有气体生成,反应后在所得溶液中加入热碱溶液可放出一种气体,其体积为280mL(标准状况),则X为锌.分析 硝酸越稀,还原产物中氮元素的价态越低.金属X跟过量稀硝酸反应,在反应过程中未见有气体生成,则说明硝酸被还原为NH3,又接着被HNO3吸收生成了NH4NO3,在所得溶液中加入热碱溶液可放出一种气体即为NH3,根据氨气的体积求出其物质的量,设每失去1mol电子所需要的X的质量为Mg,即金属X的平均摩尔电子质量为Mg/mol,然后根据得失电子数守恒来计算.
解答 解:硝酸越稀,还原产物中氮元素的价态越低.金属X跟过量稀硝酸反应,在反应过程中未见有气体生成,则说明硝酸被还原为NH3,又接着NH3被HNO3吸收生成了NH4NO3,故表现为无气体生成.在所得溶液中加入热碱溶液可放出一种气体即为NH3,体积为280mL,则生成的氨气的物质的量n=$\frac{0.28L}{22.4L/mol}$=0.0125mol.
设每失去1mol电子所需要的X的质量为Mg,即金属X的平均摩尔电子质量为Mg/mol,故3.25g金属X失去的电子的物质的量n=$\frac{3.25g}{Mg/mol}$=$\frac{3.25}{M}$mol ①
而由硝酸生成0.0125mol氨气时的电子的物质的量n=0.0125mol×8=0.1mol ②
根据在氧化还原反应中得失电子数守恒可知:$\frac{3.25}{M}$=0.1
解得M=32.5g/mol.
即此金属X每失去1mol电子所需的质量为32.5g,此金属为锌.
故答案为:锌.
点评 本题考查了在氧化还原反应中的得失电子数守恒的有关计算,应注意的是平衡摩尔电子质量的应用,难度不大.

练习册系列答案
相关题目
3.青少年学生是有知识的人,应懂得“珍爱生命、远离毒品”,以下几种药品或物质中不属于毒品的是( )
| A. | 阿司匹林 | B. | 海洛因 | C. | 大麻 | D. | 鸦片 |
4.下列溶液中的Cl浓度与50mL1mol•L-1MgCl2溶液中的Cl-浓度相等的是( )
| A. | 150mL1mol•L-1 NaCl溶液 | B. | 75 mL 0.5mol•L-1 CaCl2溶液 | ||
| C. | 150mL2mol•L-1 KCl溶液 | D. | 75 mL 1 mol•L-1 AlCl3溶液 |
1. 控制适合的条件,将反应Fe3++Ag?Fe2++Ag+设计成如右图所示的原电池,(盐桥装有琼脂-硝酸钾溶液;灵敏电流计的0刻度居中,左右均有刻度)已知,接通后,观察到电流计指针向右偏转.下列判断正确的是( )
控制适合的条件,将反应Fe3++Ag?Fe2++Ag+设计成如右图所示的原电池,(盐桥装有琼脂-硝酸钾溶液;灵敏电流计的0刻度居中,左右均有刻度)已知,接通后,观察到电流计指针向右偏转.下列判断正确的是( )
 控制适合的条件,将反应Fe3++Ag?Fe2++Ag+设计成如右图所示的原电池,(盐桥装有琼脂-硝酸钾溶液;灵敏电流计的0刻度居中,左右均有刻度)已知,接通后,观察到电流计指针向右偏转.下列判断正确的是( )
控制适合的条件,将反应Fe3++Ag?Fe2++Ag+设计成如右图所示的原电池,(盐桥装有琼脂-硝酸钾溶液;灵敏电流计的0刻度居中,左右均有刻度)已知,接通后,观察到电流计指针向右偏转.下列判断正确的是( )| A. | 在外电路中,电子从石墨电极流向银电极 | |
| B. | 盐桥中的K+移向乙烧杯 | |
| C. | 一段时间后,电流计指针反向偏转,越过0刻度,向左边偏转 | |
| D. | 电流计指针居中后,往甲烧杯中加入一定量的铁粉,电流计指针将向左偏转 |
5.某化合物在核磁共振氢谱中出现5个峰,其结构简式可能是( )
| A. | 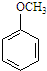 | B. | 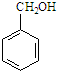 | C. | 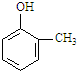 | D. |  |
9.把m mol C2H4和n mol氢气混合于密闭容器中,在适当的条件下生成了p mol C2H6,若将所得的混合气体完全燃烧生成二氧化碳和水,则需氧气( )
| A. | 3.5p mol | B. | (3m+n/2)mol | C. | (3m+n)mol | D. | (3m+n/2-3 p)mol |