��Ŀ����
14����ϩ�IJ�����һ������ʯ�ͻ���ˮƽ����Ҫ��־����ش��й���ϩ�ͱ�ϩ���й����⣮��1����Ϊ����ԭ����ϩ�ܷ�������仯��
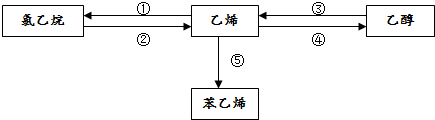
д����Ӧ�ںܵ͢Ļ�ѧ����ʽ��
��CH3CH2Cl+NaOH$��_{��}^{�Ҵ�}$CH2=CH2��+NaCl��
��CH2=CH2+H2O$\stackrel{����}{��}$CH3CH2OH��
��2����������ȱ�����ϩ�ڴ��������·���ȡ����Ӧ���÷�Ӧ�Ļ�ѧ����ʽ�ǣ�
 ��
����3����ϩ��һ������������HCl�����ӳɷ�Ӧ����X��д��X���ܵĽṹ��ʽ��CH3CH2CH2Cl��CH3CHClCH3��
���� ��1�����������������ƴ���Һ�з�����ȥ��Ӧ������ϩ����ϩ��ˮ�����ӳɷ�Ӧ�����Ҵ���
��2���ȱ�����ϩ�ڴ��������·���ȡ����Ӧ����ϩ���Ȼ��⣻
��3����ϩ��һ������������HCl�����ӳɷ�Ӧ����1-�ȱ�ϩ��2-�ȱ�ϩ��
��� �⣺��1�����������������ƴ���Һ�з�����ȥ��Ӧ������ϩ����Ӧ�ķ���ʽΪCH3CH2Cl+NaOH$��_{��}^{�Ҵ�}$CH2=CH2��+NaCl����ϩ��ˮ�����ӳɷ�Ӧ�����Ҵ�����Ӧ�ķ���ʽΪCH2=CH2+H2O$\stackrel{����}{��}$CH3CH2OH���ʴ�Ϊ��CH3CH2Cl+NaOH$��_{��}^{�Ҵ�}$CH2=CH2��+NaCl��CH2=CH2+H2O$\stackrel{����}{��}$CH3CH2OH��
��2���ȱ�����ϩ�ڴ��������·���ȡ����Ӧ����ϩ���Ȼ��⣬��Ӧ�ķ���ʽΪ ��
��
�ʴ�Ϊ�� ��
��
��3����ϩ��һ������������HCl�����ӳɷ�Ӧ����1-�ȱ�ϩ��2-�ȱ�ϩ���ṹ��ʽΪCH3CH2CH2Cl��CH3CHClCH3���ʴ�Ϊ��CH3CH2CH2Cl��CH3CHClCH3��
���� ���⿼���л���ĺϳɣ�Ϊ��Ƶ���㣬������ѧ���ķ��������Ŀ��飬�����漰ϩ�������ȴ���֮���ת����ϵ�ȣ��ѶȲ���ע�����֪ʶ���������գ�

 �������Ͽ�ʱͬ��ѵ��ϵ�д�
�������Ͽ�ʱͬ��ѵ��ϵ�д� �������ͬ����ϰϵ�д�
�������ͬ����ϰϵ�д�| t/s | 0 | 120 | 180 | 240 | 330 | 530 | 600 | 700 | 800 |
| c/mol•L-1 | 0 | 0.036 | 0.030 | 0.026 | 0.022 | 0.017 | 0.016 | 0.015 | 0.015 |
��2������15��ʱ�÷�Ӧ��ƽ�ⳣ��5.4��
��3��Ϊ���O2NC6H4COOC2H5��ƽ��ת���ʣ������ʵ����Ʒ�Ӧ�¶��⣬���ɲ�ȡ�Ĵ�ʩ��BC��
A������O2NC6H4COOC2H5
B������OH-��Ũ��
C����ȥ����
D�������ʵ��Ĵ�����
| A�� | ͬ��ͬѹ�£���ͬ��������ʣ����ǵ����ʵ�������� | |
| B�� | �κ������£������ʵ�����N2��CO�����ķ���������� | |
| C�� | 1Lһ����̼����һ����1L����������С | |
| D�� | ����Ħ����������ֵ�ϵ�����ԭ�ӵ����ԭ������ |
| A�� | $\frac{n��A-N+8��}{A+16}$mol | B�� | $\frac{n��A-N+2��}{A}$ mol | C�� | $\frac{n��A-N+8��}{A+8}$mol | D�� | $\frac{n��A-N-2��}{A}$ mol |
| A�� | CH3CH3��C2H6 | B�� | -NO2��NO2 | C�� |  ��OH- ��OH- | D�� | 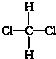 �� ��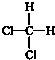 |
| A�� | -128.1kJ/mol | B�� | -1295.3kJ/mol | C�� | -157.7kJ/mol | D�� | +157.7kJ/mol |
 ����е��������ƻ�1mol���ʵĻ�ѧ�������ĵ�������
����е��������ƻ�1mol���ʵĻ�ѧ�������ĵ�������| ���� | Cl2 | Br2 | I2 | HCl | HBr | HI | H2 |
| ������kJ�� | 243 | 193 | 151 | 431 | 366 | 298 | 436 |
��1�������⻯���У���ȶ�����C
A��HCl B��HBr C��HI
��2��H2��Cl2��Ӧ����HCl�����е���ЧӦ����ͼ��ʾ����ش��������⣺
�١�H1=+243kJ•mol-1����H2=+436kJ•mol-1����H3=-431kJ•mol-1��
�ھ�ʵ��ⶨ��H2��Cl2�Ļ�������ڹ����·�Ӧ����HCl�������÷�Ӧ�IJ�������ͼ�١����з���ת��Ϊԭ�ӵ�һ��������Ϊ�ǵڢ٣�����ţ�������˵��ԭ��Cl-Cl���ļ��ܱ�H-H���ļ���С�������ѣ��Ӷ�������Ӧ��
�۸÷�Ӧ���Ȼ�ѧ����ʽΪH2��g��+Cl2��g��=2HCl��g����H=-183kJ•mol-1��
I��ij��ѧ��ȤС��Ϊ̽��Ag+��Fe3+�����ԣ����������ʵ�飺
��һ��������������˿����AgNO3��Һ�У�һ��ʱ�����˿ȡ����
�ڶ�����Ϊ������Һ��Fe�������������Һ�е�Ag+��������������ʵ�飮��ѡ�õ��Լ���KSCN��Һ������KMnO4��Һ����ˮ������ɱ���
| �� �� | ���� | ���� |
| ȡ��������Ag+�����Һ���Թ��У�����KSCN��Һ���� | ��1�� | ����Fe3+ |
| ȡ��������Ag+�����Һ���Թ��У����� ��2������ | ��3�� | ����Fe2+ |
�������ʻ�úȼ���ǵ�����Դȼ�����õ���ѷ�ʽ֮һ�������������Ⱥ����϶࣬ȼ�չ����л��γɽ����Ȼ����NaCl����Cl2�����ʣ��Խ���¯����ɸ�ʴ��
��1��NaCl��Cl2�л�ѧ�������ͷֱ������Ӽ����ۼ���
��2��ȼú���������ɵ�SO2����NaCl�����ʷ�����Ӧ�����������κ�Cl2��������Cl222.4L�������ʱת�Ƶ�����Ϊ4��6.02��1023���÷�Ӧ�Ļ�ѧ����ʽ��2NaCl+SO2+O2$\frac{\underline{\;\;��\;\;}}{\;}$Na2SO4+Cl2��
��32gͭ��l40mLһ��Ũ�ȵ����ᷴӦ��ͭ��ȫ�ܽ������NO��NO2��������ڱ�״���µ����Ϊ11.2L����ش�
�ٴ�����������ȫ���ͷź�����Һ����V mL amol•L-1��NaOH��Һ��ǡ��ʹ��Һ�е�Cu2+ȫ��ת���ɳ�������ԭ������Һ��Ũ��Ϊ$\frac{500+aV}{140}$mol/L�����ú�V��a��ʽ�ӱ�ʾ��
����ʹͭ�����ᷴӦ���ɵ�������NaOH��Һ��ȫ��ת��ΪNaNO3��������ҪH2O2������Ϊ17g��
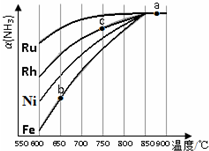 ������Һ�������ڴ��ˣ�������NH3���������
������Һ�������ڴ��ˣ�������NH3���������