��Ŀ����
���ܵ�Ԫ���ڵؿ��еķ�Ƚϵ�(��Ҫ�������ε���ʽ����)��������Ԫ���н���31λ�����Ǵ������зḻ�ĵ�������Ϊ��������Ĺ㷺Ӧ���ṩ�˿��ܡ�
��1�������ĵ���ʽΪ ���������ܽ��е��Ĺ̶���д����Ӧ����ʽ ��
��2��ʳ���̺���Ӫ�������У������ĸ߷��ӻ������� (������)����ˮ������ղ���Ϊ ��
��3�������е�NH4+������ϸ���Ĵ������¿�ת��ΪNO3����д�������ӷ���ʽ�� ��
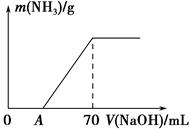
��4��ijͭ���Ͻ�������ϡ������ȫ�ܽ⣬�õ���״����NO 11.2 L��������Һ�м��������ˮ����ַ�Ӧ����ˡ�����Һ������ɫ����Ϊ���е�����(�ѧʽ)�� ��������������Ϊ7.8g����Ͻ������Ϊ g��
��1��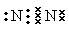 N2+O2
N2+O2 2NO�� ��2�������ʣ������
2NO�� ��2�������ʣ������
��3��NH4++2O2 NO3-+H2O+2H+ ��4��Cu(NH3)42+ ��41.1
NO3-+H2O+2H+ ��4��Cu(NH3)42+ ��41.1
���������������1����N2����������Nԭ�ӹ������Ե��ӡ����Ե����ĵ���ʽΪ ���ڵ��������N2��O2������Ӧ�õ�NO����Ӧ�ķ���ʽΪN2+O2
���ڵ��������N2��O2������Ӧ�õ�NO����Ӧ�ķ���ʽΪN2+O2 2NO����2��ʳ���̺���Ӫ�������У������ĸ߷��ӻ������ǵ����ʣ���������������İ��������ͨ����ˮ���϶��ɡ������ˮ������ղ���Ϊ�����ᡣ��3�������е�NH4+������ϸ���Ĵ������¿�ת��ΪNO3������Ӧ�����ӷ���ʽNH4++2O2
2NO����2��ʳ���̺���Ӫ�������У������ĸ߷��ӻ������ǵ����ʣ���������������İ��������ͨ����ˮ���϶��ɡ������ˮ������ղ���Ϊ�����ᡣ��3�������е�NH4+������ϸ���Ĵ������¿�ת��ΪNO3������Ӧ�����ӷ���ʽNH4++2O2 NO3-+H2O+2H+����4��ijͭ���Ͻ�������ϡ������ȫ�ܽ⣬������Ӧ��3Cu��8HNO3(ϡ)=2Cu(NO3)2��2NO����4H2O��Al��4HNO3(ϡ)=Al(NO3)3��NO����2H2O.������Һ�м��������ˮʱ�����ڰ�ˮΪ��������ܽ������Al(OH)3���������Է�����Ӧ��Al(NO3)3+3NH3��H2O= Al(OH)3��+ 3NH4NO3��Cu(NO3)2+6NH3��H2O=[Cu(NH3)4](OH)2��2H2O+ 2NH4NO3.����Һ������ɫ����Ϊ���е�����ͭ�������ӡ����İ���ͭ����[Cu(NH3)4] 2-��n(Al(OH)3)=7.8g��78g/mol="0.1mol." m(Al)=2.7g.���ݷ���ʽ Al��4HNO3(ϡ)=Al(NO3)3��NO����2H2O��֪Al������NO�����ʵ���Ϊ0.1mol,��Cu������NO�����ʵ���Ϊ0.5mol-0.1mol=0.4mol.�ɷ���ʽ 3Cu��8HNO3(ϡ)=2Cu(NO3)2��2NO����4H2O��֪Cu�����ʵ���Ϊ0.6mol.m(Cu)=" 0.6mol" ��64g/mol=38.4g.���ԺϽ������Ϊ38.4g=41.1g��
NO3-+H2O+2H+����4��ijͭ���Ͻ�������ϡ������ȫ�ܽ⣬������Ӧ��3Cu��8HNO3(ϡ)=2Cu(NO3)2��2NO����4H2O��Al��4HNO3(ϡ)=Al(NO3)3��NO����2H2O.������Һ�м��������ˮʱ�����ڰ�ˮΪ��������ܽ������Al(OH)3���������Է�����Ӧ��Al(NO3)3+3NH3��H2O= Al(OH)3��+ 3NH4NO3��Cu(NO3)2+6NH3��H2O=[Cu(NH3)4](OH)2��2H2O+ 2NH4NO3.����Һ������ɫ����Ϊ���е�����ͭ�������ӡ����İ���ͭ����[Cu(NH3)4] 2-��n(Al(OH)3)=7.8g��78g/mol="0.1mol." m(Al)=2.7g.���ݷ���ʽ Al��4HNO3(ϡ)=Al(NO3)3��NO����2H2O��֪Al������NO�����ʵ���Ϊ0.1mol,��Cu������NO�����ʵ���Ϊ0.5mol-0.1mol=0.4mol.�ɷ���ʽ 3Cu��8HNO3(ϡ)=2Cu(NO3)2��2NO����4H2O��֪Cu�����ʵ���Ϊ0.6mol.m(Cu)=" 0.6mol" ��64g/mol=38.4g.���ԺϽ������Ϊ38.4g=41.1g��
���㣺�������ʽ�����ӷ���ʽ����ѧ����ʽ����д���Ͻ���ij�ɷֺ����ļ����֪ʶ��

 ��һ������Ԫͬ�����ؾ�ϵ�д�
��һ������Ԫͬ�����ؾ�ϵ�д�1gN2��a�����ӣ����ӵ������ɱ�ʾΪ�� ��
| A��a/28mol-1 | B��a mol-1 | C��28a mol-1 | D��a/14 mol-1 |
��84����Һ������Чɱ�����H1N1������ijͬѧ������һƿijƷ�ơ�84����Һ����
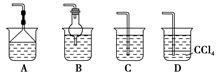
������������Ϻ�����Һ��װ˵���õ�������Ϣ��
��84����Һ������25% NaClO��1 000 mL���ܶ�1.19 g��cm��3��ϡ��100��(�����)��ʹ�á������������Ϣ�����֪ʶ�ش��������⣺
(1)�á�84����Һ�������ʵ���Ũ��Ϊ________mol��L��1��
(2)��ͬѧȡ100 mL��Ʒ�ơ�84����Һ��ϡ�ͺ�����������ϡ�ͺ����Һ��c(Na�� )��________mol��L��1(����ϡ�ͺ���Һ�ܶ�Ϊ1.0 g��cm��3)��
(3)��ͬѧ���ĸ�Ʒ�ơ�84����Һ�����䷽������NaClO��������480 mL��25% NaClO������Һ������˵����ȷ����________��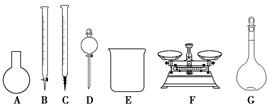
| A����ͼ��ʾ�������У��������Dz���Ҫ�ģ�����һ�ֲ������� |
| B������ƿ������ˮϴ����Ӧ��ɲ���������Һ���� |
| C�����ù������ƷNaClO�����ƿ��ܵ��½��ƫ�� |
| D����Ҫ������NaClO��������Ϊ143 g |