题目内容
【题目】下图为人工肾脏采用间接电化学方法除去代谢产物中的尿素(CO(NH2)2)的原理。请回答下列问题:
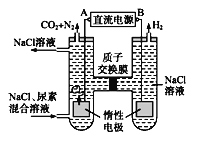
(1)电源的负极为____(选填“A”或“B”)。
(2)阳极室中发生的反应依次为________________、_________________________。
(3)电解结束后,阴极室溶液的pH与电解前相比将___(选填“降低”、“增大”或“不变”)。
(4)若两极共收集到标准状况下气体6.72 L,则除去的尿素为__g(忽略气体的溶解)。
【答案】B 2Cl--2e-![]() Cl2↑ CO(NH2)2+3Cl2+H2O
Cl2↑ CO(NH2)2+3Cl2+H2O![]() N2+CO2+6HCl 不变 3.6
N2+CO2+6HCl 不变 3.6
【解析】
从图分析,右侧产生氢气,说明是溶液中的氢离子反应,说明电极为阴极,则对应的B极为负极,A为正极。
从图分析,右侧产生氢气,说明是溶液中的氢离子反应,说明电极为阴极,则对应的B极为负极,A为正极。(1)根据分析,B为负极。
(2)阳极是溶液中的氯离子放电生成氯气,氯气氧化尿素反应生成二氧化碳和氮气,方程式为:2Cl--2e-![]() Cl2↑,CO(NH2)2+3Cl2+H2O
Cl2↑,CO(NH2)2+3Cl2+H2O![]() N2+CO2+6HCl;
N2+CO2+6HCl;
(3)两室中间为质子交换膜,所以阴极附近氢离子反应生成氢气,然后阳极室中的氢离子通过质子交换膜,所以溶液中氢离子浓度不变,故溶液的pH不变。
(4)根据电极反应分析,当反应生成3mol氯气时消耗1mol尿素,生成2mol气体,同时阴极产生3mol氢气,即产生5mol气体是消耗1mol尿素,现在产生6.72L气体,即产生6.72/22.4=0.3mol气体时,消耗0.06mol ,质量为0.06 mol×60g/ mol =3.6g。

 芝麻开花课程新体验系列答案
芝麻开花课程新体验系列答案【题目】含氮化合物在材料方面的应用越来越广泛。
(1)甲胺(CH3NH2)是合成太阳能敏化剂的原料。工业合成甲胺原理:
CH3OH(g)+NH3(g)![]() CH3NH2(g)+H2O(g)△H。
CH3NH2(g)+H2O(g)△H。
①已知键能指断开1mol气态键所吸收的能量或形成1mol气态键所释放的能量。几种化学键的键能如下表所示:
化学键 | C-H | C-O | H-O | N-H | C-N |
键能/kJ·mol-1 | 413 | 351 | 463 | 393 | 293 |
则该合成反应的△H=______________。
②一定条件下,在体积相同的甲、乙、丙、丁四个容器中,起始投入物质如下:
NH3(g)/mol | CH3OH(g)/mol | 反应条件 | |
甲 | 1 | 1 | 498K,恒容 |
乙 | 1 | 1 | 598K,恒容 |
丙 | 1 | 1 | 598K,恒压 |
丁 | 2 | 3 | 598K,恒容 |
达到平衡时,甲、乙、丙、丁容器中的CH3OH转化率由大到小的顺序为_______________。
(2)工业上利用镓(Ga)与NH3在高温下合成固体半导体材料氮化镓(GaN),其反应原理为2Ga(s)+2NH3(g)![]() 2GaN(s)+3H2(g)△H=-30.81kJ·mol-1。
2GaN(s)+3H2(g)△H=-30.81kJ·mol-1。
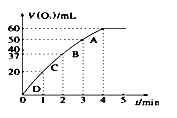
①在密闭容器中充入一定量的Ga与NH3发生反应,实验测得反应体系与温度、压强的相关曲线如图所示。图中A点与C点的化学平衡常数分别为KA和KC,下列关系正确的是_________(填代号)。
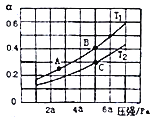
a.纵轴a表示NH3的转化率 b.纵轴a表示NH3的体积分数 c.T1<T2 d.KA<Kc
②镓在元素周期表位于第四周期第ⅢA族,化学性质与铝相似。氮化镓性质稳定,不溶于水,但能缓慢溶解在热的NaOH溶液中,该反应的离子方程式为_____________________。
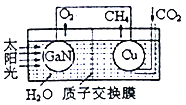
(3)用氮化镓与铜组成如图所示的人工光合系统,利用该装置成功地以CO2和H2O为原料合成CH4。铜电极表面发生的电极反应式为___________。两电极放出O2和CH4相同条件下的体积比为________,为提高该人工光合系统的工作效率,可向装置中加入少量的__________(填“盐酸”或“硫酸”)。
【题目】有关下列四个常用电化学装置的叙述中,正确的是
|
|
|
|
图Ⅰ碱性锌锰电池 | 图Ⅱ铅-硫酸蓄电池 | 图Ⅲ电解精炼铜 | 图Ⅳ银锌纽扣电池 |
A. 图Ⅰ所示电池中,MnO2的作用是催化剂
B. 图Ⅱ所示电池放电过程中,硫酸浓度不断增大
C. 图Ⅲ所示装置工作过程中,电解质溶液中Cu2+浓度始终不变
D. 图Ⅳ所示电池中,Ag2O是氧化剂,电池工作过程中还原为Ag