题目内容
【题目】如图所示,组成一种原电池。试回答下列问题(灯泡功率合适):
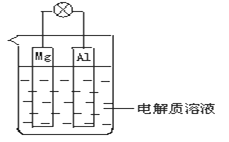
(1)电解质溶液为稀H2SO4时,灯泡______(填“亮”或“不亮”)。若灯泡亮,则Mg电极上发生的反应为:______;Al电极上发生的反应为:______。若灯泡不亮,其理由为:________________。
(2)电解质溶液为NaOH(aq)时,灯泡______(填“亮”或“不亮”)。若灯泡亮,则Mg电极上发生的反应为:______;Al电极上开始时发生的反应为:______。若灯泡不亮,其理由为____________。
【答案】 亮 Mg-2e-==Mg2+ 2H++2e-=H2↑ 硫酸太稀,没有足够的阴、阳离子 亮 6H2O+6e-==3H2↑+6OH- 2Al-6e-+8OH- ==2AlO2-+4H2O 电解质中没有足够的阴、阳离子
【解析】考查原电池的构成和电极反应式的书写,(1)符合构成原电池的条件,因此有电流通过,灯泡发亮,镁比Al活泼,能与硫酸反应,因此镁作负极,电极反应式为Mg-2e-=Mg2+,Al作正极,电极反应式为2H++2e-=H2↑,导电能力的强弱与溶液阴阳离子浓度以及所带电荷数有关,灯泡不亮,说明溶液中离子浓度非常小,可能是硫酸浓度太稀;(2)铝与NaOH溶液发生反应,即2Al+2NaOH+2H2O=2NaAlO2+3H2↑,此反应属于氧化还原反应,构成原电池,有电流通过,灯泡变亮,Mg的金属性强于Al,但Mg不与NaOH反应,因此Mg作正极,Al作负极,Mg电极反应式为6H2O+6e-==3H2↑+6OH-,Al电极反应式为2Al+8OH--6e-=2AlO2-+4H2O,灯泡不亮,原因是:电解质中没有足够的阴、阳离子。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】常温下,在pH=12的NaOH溶液中,由水电离出的c(OH-)为( )
A.1.0×10-7mol/LB.1.0×10-6mol/L
C.1.0×10-3mol/LD.1.0×10-12mol/L
【题目】某兴趣小组设计出如图所示装置来改进教材中“铜与硝酸反应”实验,以探究化学实验的绿色化。

(1)实验前,关闭活塞b,试管d中加水至浸没长导管口,塞紧试管c和d的胶塞,加热c,其目的是 __________________。
(2)在d中加适量NaOH溶液,c中放一小块铜片,由分液漏斗a向c中加入2 mL浓硝酸,c中反应的化学方程式是________________。再由a向c中加2 mL蒸馏水,c中的实验现象是_________________。
(3)下表是制取硝酸铜的三种方案,能体现绿色化学理念的最佳方案是___________,理由是___________。
方案 | 反应物 |
甲 | Cu、浓 HNO3 |
乙 | Cu、稀HNO3 |
丙 | Cu、O2、稀HNO3 |
(4)该小组还用上述装置进行实验证明氧化性KMnO4>Cl2>Br2,操作步骤为___________,实验现象为 __________,但此实验的不足之处是 _________________。
