题目内容
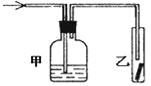
【题目】甲、乙两烧杯中各盛有1L0.6mol· L-1的盐酸和 NaOH溶液,向两烧杯中分别加入等质量的铝粉,反应结束后测得生成的气体的体积比为V(甲) : V(乙)= 3: 4,则加入铝粉的质量为
A.7.2 gB.5.4 gC.3.6 gD.2.7 g
【答案】A
【解析】
甲、乙两烧杯中各盛有1L0.6mol· L-1的盐酸和 NaOH溶液,向两烧杯中分别加入等质量的铝粉,分别发生反应2Al+6HCl=AlCl3+3H2↑,2Al+2NaOH+2H2O=2NaAlO2+3H2↑;反应结束后测得生成的气体的体积比为V(甲) : V(乙)= 3: 4,甲烧杯放出的氢气少,说明甲中铝有剩余,盐酸完全反应,n(HCl)=0.6mol,根据方程式2Al+6HCl=AlCl3+3H2↑,生成氢气的物质的量是0.3mol,则乙中生成氢气的物质的量是0.4mol,根据方程式2Al+2NaOH+2H2O=2NaAlO2+3H2↑,消耗铝的物质的量是![]() ,铝的质量是
,铝的质量是![]() ×27g/mol=7.2g,故选A。
×27g/mol=7.2g,故选A。

 小学学习好帮手系列答案
小学学习好帮手系列答案 小学同步三练核心密卷系列答案
小学同步三练核心密卷系列答案【题目】下表列出了①~⑨九种元素在周期表中的位置.
族 周期 | ⅠA | 0 | ||||||
1 | ① | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | |
2 | ② | ③ | ④ | ⑤ | ||||
3 | ⑥ | ⑦ | ||||||
4 | ⑧ | ⑨ |
请按要求回答下列问题.
(1)这九种元素中,原子半径最大的是(填元素符号)__;元素⑤的原子结构示意图为___.
(2)③、④、⑤三种元素的气态氢化物中,热稳定性最弱的物质是(填化学式)______.
(3)写出元素⑧的单质与水反应的化学方程式:______.
(4)写出元素⑦的单质与元素⑨的钠盐溶液反应的离子方程式:______.
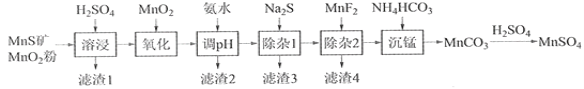
【题目】高纯硫酸锰作为合成镍钴锰三元正极材料的原料,工业上可由天然二氧化锰粉与硫化锰矿(还含Fe、Al、Mg、Zn、Ni、Si等元素)制备,工艺如下图所示。回答下列问题:
相关金属离子[c0(Mn+)=0.1 mol·L1]形成氢氧化物沉淀的pH范围如下:
金属离子 | Mn2+ | Fe2+ | Fe3+ | Al3+ | Mg2+ | Zn2+ | Ni2+ |
开始沉淀的pH | 8.1 | 6.3 | 1.5 | 3.4 | 8.9 | 6.2 | 6.9 |
沉淀完全的pH | 10.1 | 8.3 | 2.8 | 4.7 | 10.9 | 8.2 | 8.9 |
(1)“滤渣1”含有S和__________________________;写出“溶浸”中二氧化锰与硫化锰反应的化学方程式_______________________________________。
(2)“氧化”中添加适量的MnO2的作用是将________________________,检验生成离子试剂___________。
(3)“调pH”除铁和铝,溶液的pH范围应调节为_______~6之间,除铝的离子反应方程式是__________。
(4)“除杂1”的目的是除去Zn2+和Ni2+,“滤渣3”的主要成分是______________。
(5)氧化中除了添加适量MnO2还可以用H2O2来氧化,写出该离子反应_______________。
(6)写出“沉锰”的离子方程式_______________________________________。
(7)层状镍钴锰三元材料可作为锂离子电池正极材料,其化学式为LiNixCoyMnzO2,其中Ni、Co、Mn的化合价分别为+2、+3、+4。当x=y=![]() 时,z=___________。
时,z=___________。
(8)写出Fe2+和HNO3的离子反应__________。