题目内容
【题目】A、B、C、D、E、F、G是前四周期(除稀有气体)原子序数依次增大的七种元素,A的原子核外电子只有一种运动状态;B、C的价电子层中未成对电子数都是2;B、C、D同周期;E核外的s、p能级的电子总数相筹;F与E同周期且第一电离能比E小;G的+1价离子(G+)的各层电子全充满。回答下列问题:(相关问题用元素符号表示)
(1)写出E的基态原子的电子排布式________________________。
(2)B与C可形成化合物BC和BC2,BC2属于__________(填“极性”、“非极性”)分子,1 mol BC含有π键为____________________mol。
(3)由元素A、C、G组成的离子[G(A2C)4]2+在水溶液中显天蓝色,不考虑空间结构,[G(A2C)4]2+的结构可用示意图表示为__________(配位键用→标出)。
(4)测定A、D形成的化合物的相对分子质量时,实验测定值一般高于理论值的原因是_______。
(5)由元素A、B、F组成的原子个数比9 : 3 : 1的一种物质,分子中含三个相同的原子团,其结构简式为________________,分子中F原子的杂化方式为__________,该物质遇水爆炸,生成白色沉淀和无色气体,反应的化学方程式为____________________。
【答案】(1)1s22s22p63s2(2分)(2)非极性(1分)2(1分)
(3)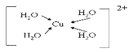 (2分)
(2分)
(4)HF分子之间存在氢键,形成缔合分子(2分)
(5)Al(CH3)3 (1分) sp2杂化(2分)Al(CH3)3+3H2O = Al(OH)3↓+3CH4↑(2分)
【解析】试题分析:根据A的原子核外电子只有一种运动状态可知A为氢元素;B、C的价电子层中未成对电子数都是2且原子序数依次增大可知B、C分别为碳元素和氧元素;根据B、C、D同周期可知D为氟元素;E核外的s、p能级的电子总数相等可知E的电子排布式为1s22s22p63s2,即E为镁元素,由于原子序数依次增大且F与E同周期,第一电离能F比E小,E为半充满第一电离反常,则F为铝元素;G的+1价离子(G+)的各层电子全充满,可知G为铜元素。
(1)镁元素的基态原子的电子排布式为1s22s22p63s2;
(2)CO2分子中没有孤电子对,所以属于非极性分子,CO与氮气互为等电子体,氮气的结构式为N≡N,所以CO中含有碳氧三键,每个三键中含有2个π键,则1 mol CO含有π键为2mol;
(3)[Cu(H2O)4]2+中含有配位键,Cu2+中有空轨道,H2O中O存在孤电子对,所以结构可用示意图表示为 。
。
(4)由于HF分子之间存在氢键,形成缔合分子(HF)n,所以实验测定值一般高于理论值。
(5)由元素A、B、F组成的原子个数比9 : 3 : 1的一种物质的分子式为AlC3H9,由于分子中含三个相同的原子团,即为CH3,所以结构简式为 Al(CH3)3,CH3中碳原子的杂化方式为sp2杂化,该物质遇水爆炸,生成白色沉淀为Al(OH)3和无色气体CH4,反应方程式为Al(CH3)3+3H2O = Al(OH)3↓+3CH4↑。

 阅读快车系列答案
阅读快车系列答案