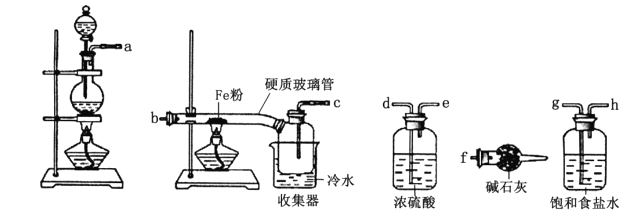
题目内容
【题目】某蓄电池放电、充电的反应式为:Fe+Ni2O3+3H2O ![]() Fe(OH)2+2Ni(OH)2 , 下列推断中正确的是( )
Fe(OH)2+2Ni(OH)2 , 下列推断中正确的是( )
①放电时,Fe为正极,Ni2O3为负极;
②充电时,阴极上的电极反应式是:Fe(OH)2+2e﹣═Fe+2OH﹣;
③充电时,Ni(OH)2为阳极;
④蓄电池的电极必须浸在某碱性溶液中.
A.①②③
B.②③
C.①③④
D.②③④
【答案】D
【解析】解:①、由放电时的反应可以得出铁做还原剂失去电子,Ni2O3做氧化剂得到电子,即正极为Ni2O3、负极为Fe,故①错误;
②、充电可以看作是放电的逆过程,即阴极为原来的负极,所以电池放电时,负极反应为:Fe+2OH﹣﹣2e﹣=Fe(OH)2 , 所以电池充电过程时阴极反应为Fe(OH)2+2e﹣=Fe+2OH﹣ , 故②正确;
③、充电时,阴极发生Fe(OH)2+2e﹣=Fe+2OH﹣ , 阳极发生2Ni(OH)2+2OH﹣﹣2e﹣=Ni2O3+3H2O,Ni(OH)2做阳极,故③正确.
④、根据总反应Fe+Ni2O3+3H2O=Fe(OH)2+2Ni(OH)2 , 可以判断出铁镍蓄电池放电时Fe作负极,发生氧化反应,为还原剂,失电子生成Fe2+ , 碱性电解质中最终生成Fe(OH)2 , 所以电解质溶液是碱,故④正确;
故选D.
根据电池的总反应:Fe+Ni2O3+3H2O=Fe(OH)2+2Ni(OH)2 , 可以判断出铁镍蓄电池放电时Fe作负极,发生氧化反应,为还原剂,失电子生成Fe2+ , 最终生成Fe(OH)2 , Ni2O3作正极,发生还原反应,为氧化剂,得电子,最终生成Ni(OH)2 , 电池放电时,负极反应为Fe+2OH﹣﹣2e﹣=Fe(OH)2 , 则充电时,阴极发生Fe(OH)2+2e﹣=Fe+2OH﹣ , 阴极附近溶液的pH升高,电池充电时,阳极发生2Ni(OH)2+2OH﹣﹣2e﹣=Ni2O3+3H2O.