题目内容
【题目】东晋《华阳国志·南中志》卷四中关于白铜的记载——云南镍白铜(铜镍合金),曾主要用于造币,亦可用于制作仿银饰品。回答下列问题:
(1)Ni2+基态原子的电子排布式为_______;3d能级上的未成对电子数为____。
(2)单质铜及镍都是由 _____键形成的晶体;元素铜与镍的第二电离能分别为:Icu =1958kJmol-1、INi=1753 kJmol-1,Icu >I Ni的原因是 ________________。
(3)Ni2+与丁二酮肟生成鲜红色丁二酮肟镍沉淀,该反应可用于检验 Ni2+。
2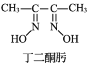 +Ni2+→
+Ni2+→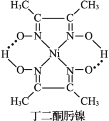 ↓+2H+
↓+2H+
①1 mol 丁二酮肟分子中含有σ 键的数目为_______mol。
②丁二酮肟镍分子中碳原子的杂化轨道类型为_____________。
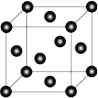
(4)Ni 的晶胞结构如图所示,镍晶体配位数目是__________ ;若 Ni 的原子半径为 d pm,Ni 的密度计算表达式是______g/cm3;Ni 原子空间利用率的计算表达式是_________。(Ni 的相对原子量用 Mr 表示)
【答案】1s22s22p63s23p63d84s2或[Ar]3d84s2 2 金属 铜失去的是全充满的3d10电子,镍失去的是4s1电子 15 sp3、sp2 12 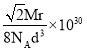
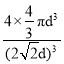
【解析】
(1)Ni为第28号元素,其基态原子核外电子排布式为1s22s22p63s23p63d84s2或[Ar]3d84s2,3d能级上未成对电子式为2;
(2)Ni和Cu都是由金属键形成的金属晶体,元素铜与镍的第二电离能分别为:Icu=1958kJmol-1、INi=1753kJmol-1,Icu>I Ni的原因是铜失去的是全充满的3d10电子,镍失去的是4s1电子;
(3)①已知丁二酮肟的结构式为![]() ,分子中含有13个单键和2个双键,则共有15个σ键,所以1mol丁二酮肟含有σ键数为15NA;
,分子中含有13个单键和2个双键,则共有15个σ键,所以1mol丁二酮肟含有σ键数为15NA;
②甲基上碳原子价层电子对个数是4且不含孤电子对,为sp3杂化,连接甲基的碳原子含有3个价层电子且不含孤电子对,为sp2杂化;
(4)镍晶体的晶胞为面心立方,配位数目是12;Ni的密度应由晶胞内Ni的质量除以晶胞体积计算,晶胞中Ni的个数有![]() =4个,故晶胞质量为
=4个,故晶胞质量为![]() g,又已知Ni原子的半径为d pm,晶胞棱长为
g,又已知Ni原子的半径为d pm,晶胞棱长为![]() pm,晶胞体积为
pm,晶胞体积为![]() pm3=
pm3=![]() cm3,故晶胞密度为
cm3,故晶胞密度为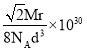 g/cm3;空间利用率的计算表达式为
g/cm3;空间利用率的计算表达式为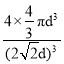

 名校课堂系列答案
名校课堂系列答案