题目内容
【题目】磷的重要化合物NaH2PO4、Na2HPO4和Na3PO4可通过H3PO4与NaOH溶液反应获得。室温下,含磷各物种的分布分数(平衡时某物种的浓度占各物种浓度之和的分数)与pH的关系如下图所示。
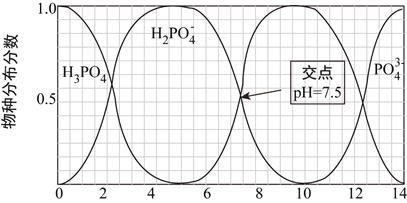
下列说法中正确的是( )
A. 电离方程式:H3PO4=3H++PO43-
B. pH=7时存在c(Na+)=c(H2PO4-)+c(HPO42-)
C. 向Na3PO4溶液中加入NaH2PO4溶液,不会发生化学反应
D. 相同温度和浓度下,H2PO4-的电离能力弱于HPO42-的水解能力
【答案】D
【解析】A.由图示可知,H3PO4是多元中强酸,不可能完全电离,分步电离,故A错误;B.由图示可知当pH=7时溶液中存在的电荷守恒式为c(H+)+c(Na+)=c(H2PO4-)+2c(HPO42-)+c(OH-),即c(Na+)=c(H2PO4-)+2c(HPO42-),故B错误;C.由图示可知,PO43-和H2PO4-不可能同时存在于溶液中,则向Na3PO4溶液中加入NaH2PO4溶液,会发生化学反应,生成Na2HPO4,故C错误;D.由图示可知,等浓度的HPO42-和H2PO4-的混合溶液中,溶液pH=7.5,显碱性,则说明相同温度和浓度下,H2PO4-的电离能力弱于HPO42-的水解能力,故D正确;答案为D。

 暑假作业暑假快乐练西安出版社系列答案
暑假作业暑假快乐练西安出版社系列答案【题目】室温下,将一元酸HA的溶液和KOH溶液等体积混合(忽略体积变化),实验数据如下表:
实验编号 | 起始浓度/(mol·L-1) | 反应后溶液的pH | |
c(HA) | c(KOH) | ||
① | 0.1 | 0.1 | 9 |
② | x | 0.2 | 7 |
下列判断不正确的是( )
A. 实验①反应后的溶液中:c(K+)>c(A-)>c(OH-)>c(H+)
B. 实验①反应后的溶液中:c(OH-)=c(K+)-c(A-)=![]() mol/L
mol/L
C. 实验②反应后的溶液中:c(A-)+c(HA)>0.1mol/L
D. 实验②反应后的溶液中:c(K+)=c(A-)>c(OH-)=c(H+)