题目内容
【题目】KAl(SO4)2·12H2O(明矾)是一种复盐,在造纸等方面应用广泛。实验室中,采用废易拉罐(主要成分为Al,含有少量的Fe、Mg杂质)制备明矾的过程如下图所示。
![]()
![]()
![]()
![]()
![]()
回答下列问题:
(1)为尽量少引入杂质,试剂①应选用NaOH溶液,若选用H2SO4溶液,其后果是________________________ 。
(2)易拉罐溶解过程中主要反应的化学方程式为____________________________;滤液A中的某种离子与NH4+、HCO3-均能反应生成沉淀B,该离子与NH4+反应的离子方程式为_____________________________________________。
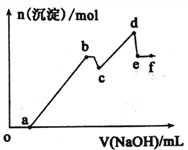
(3)明矾与硫磺焙烧时发生反应的化学方程式为:KAl(SO4)2·12H2O+S![]() K2SO4+Al2O3+SO2↑+H2O(未配平),配平后的化学计量数依次为___________________________;每生成67.2L标准状况下的SO2,转移电子的物质的量为________;焙烧产生的SO2经催化氧化、吸收等过程可制得硫酸,若SO2催化氧化时的转化率为96.0%,则理论上用该法生成硫酸时硫元素的总转化率为__________。
K2SO4+Al2O3+SO2↑+H2O(未配平),配平后的化学计量数依次为___________________________;每生成67.2L标准状况下的SO2,转移电子的物质的量为________;焙烧产生的SO2经催化氧化、吸收等过程可制得硫酸,若SO2催化氧化时的转化率为96.0%,则理论上用该法生成硫酸时硫元素的总转化率为__________。
(4)实验室需要用1mol/L的KAl(SO4)2溶液225ml,用明矾配制用到的玻璃仪器有____________________________________。
【答案】 引入杂质Fe2+、Mg2+ 2Al+2NaOH+2H2O=2NaAlO2+3H2↑ AlO2- + NH4+ +2H2O = Al(OH)3↓ + NH3·H2O (或AlO2- + NH4+ +H2O = Al(OH)3↓ + NH3↑) 4、3、2、2、9、48 4 mol 78.5% 烧杯 玻璃棒 250ml容量瓶 胶头滴管
【解析】(1)易拉罐(主要成分为Al,含有少量的Fe、Mg杂质),它们都是比较活泼的金属,都可以与酸发生反应,而Al可以与强碱溶液反应变为NaAlO2进入溶液,而Fe、Mg不能与碱发生反应,所以要以含Al的易拉罐为原料制取明矾,应该用强碱NaOH溶液溶解,若选用H2SO4溶液,Fe、Mg会与H2SO4反应生成Fe2+、Mg2+,其后果是引入杂质Fe2+、Mg2+。
(2)易拉罐溶解过程中主要反应的化学方程式为2Al+2NaOH+2H2O==2NaAlO2+3H2↑;
从流程图分析 ,可知沉淀B化学式为Al(OH)3 ,滤液A的主要成分是NaAlO2,向其水溶液中加入NH4HCO3溶液,AlO2-、NH4+发生盐的双水解反应,产生Al(OH)3沉淀和NH3·H2O,反应的方程式是AlO2-+2H2O+NH4+= Al(OH)3↓+NH3·H2O。
(3)该反应中,S元素的化合价由0价和+6价变为+4价,所以部分4KAl(SO4)212H2O作氧化剂(6个硫酸根被还原,2个硫酸根保持不变),硫作还原剂,还原剂和氧化剂的物质的量之比为3:3,故化学方程式配平后为:4KAl(SO4)212H2O+3S=2K2SO4+2Al2O3+9SO2+48H2O,则配平后的化学计量数依次为4、3、2、2、9、48 。从化学方程式中可知,反应中共转移了12 mole-,生成9 mol SO2,故每生成67.2L标准状况下的SO2,转移电子的物质的量为(67.2L╳12 mol)÷(22.4 L/mol╳9)=4 mol 。据总反应可知,共有11个S(4KAl(SO4)212H2O+3S)参与反应生成9 SO2,若SO2催化氧化时的转化率为96.0%,则理论上用该法生成硫酸时硫元素的总转化率为:9÷11╳96.0%=78.5% 。
(4)实验室没有225mL容量瓶,所以选择250mL容量瓶,操作步骤有计算、称量、溶解、移液、洗涤移液、定容、摇匀等操作,一般用托盘天平称量,用药匙取用药品,在烧杯中溶解,用玻璃棒搅拌,加速溶解,恢复室温后转移到500mL容量瓶中,并用玻璃棒引流,洗涤2-3次,并将洗涤液移入容量瓶中,当加水至液面距离刻度线1~2cm时,改用胶头滴管滴加,最后定容颠倒摇匀.所以需要的仪器有托盘天平、烧杯、500ml的容量瓶、胶头滴管、药匙,配制用到的玻璃仪器有烧杯 玻璃棒 250ml容量瓶 胶头滴管。