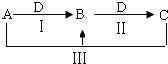
题目内容
【题目】A、B两元素的最外层都只有一个电子,A的原子序数等于B的原子序数的11倍,A离子的电子层结构与周期表中非金属性最强的元素的阴离子的电子层结构相同;元素C与B易形成化合物B2C,该化合物常温下呈液态,则:
(1)A的原子结构示意图为____,在固态时属于___晶体。
(2)C的单质属于___晶体。B与C形成化合物B2C的化学式为___,电子式为____;它是由___键形成的___分子,在固态时属于___晶体。
【答案】![]() 金属 分子 H2O
金属 分子 H2O ![]() 极性共价 极性 分子
极性共价 极性 分子
【解析】
由题干信息,A、B两元素的最外层都只有一个电子,A离子的电子层结构与周期表中非金属性最强的元素的阴离子的电子层结构相同,则A为Na元素,A的原子序数等于B的原子序数的11倍,则B为H元素,元素C与B易形成化合物B2C,该化合物常温下呈液态,则C为O元素,据此分析解答。
(1)根据上述分析可知,A为Na元素,其核外有11个电子,原子结构示意图为![]() ,Na在固态时属于金属晶体;
,Na在固态时属于金属晶体;
(2)C为O元素,其单质为O2,属于分子晶体,H与O形成的化合物为H2O,分子中H和O形成共用电子对,其电子式为![]() ,H和O形成极性共价键,因为正负电荷的中心不重合,所以H2O是极性分子,在固态时,H2O属于分子晶体。
,H和O形成极性共价键,因为正负电荷的中心不重合,所以H2O是极性分子,在固态时,H2O属于分子晶体。

 名校课堂系列答案
名校课堂系列答案【题目】海水中含有丰富的镁资源。某同学设计了从模拟海水中制备MgO的实验方案:
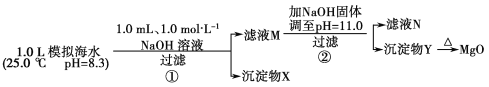
模拟海水中的离子浓度/mol·L-1 | Na+ | Mg2+ | Ca2+ | Cl- | HCO3- |
0.439 | 0.050 | 0.011 | 0.560 | 0.001 |
注:溶液中某种离子的浓度小于1.0×10-5 mol·L-1,可认为该离子不存在;实验过程中,假设溶液体积不变。Ksp[CaCO3]=4.96×10-9,Ksp[MgCO3]=6.82×10-6,Ksp[Ca(OH)2]=4.68×10-6,Ksp[Mg(OH)2]=5.61×10-12。下列说法正确的是( )
A.沉淀物X为CaCO3
B.滤液M中存在Mg2+,不存在Ca2+
C.滤液N中存在Mg2+、Ca2+
D.步骤②中若改为加入4.2 g NaOH固体,沉淀物Y为Ca(OH)2和Mg(OH)2的混合物