��Ŀ����
����Ŀ��100mLij��Һ�п��ܺ���H+��NH4+��Mg2+��Al3+��Fe3+��CO32����SO42����NO3���еļ��֣���������п���������H2����������NaOH��Һ��������ɫ�������Ҳ����ij����������NaOH�����ʵ���֮��Ĺ�ϵ��ͼ��ʾ����
��1����Һ��һ�����е��������� �� һ�������е������� ��
��2��C��D�����ӷ���ʽΪ ��
��3����A��B��C��D���й����ݿɼ������ij�������ӵ����ʵ���Ũ�ȷֱ�ΪmolL��1��molL��1 �� 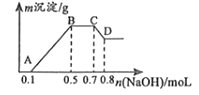
���𰸡�
��1��H+��NH4+��Mg2+��Al3+��CO32����NO3����Fe3+
��2��Al��OH��3+OH��=AlO2��+2H2O
��3��1��0.5
���������⣺���ݢٿ�֪����Һ�����ԣ�����Һ��һ��������CO32����NO3���� ���ݢڿ�֪���������ǰ�ɫ������˵��������Fe3+�����ݲ����ij����������NaOH�����ʵ���֮��Ĺ�ϵͼ��֪����Һ��һ������Mg2+��Al3+������Ϊ�������ﵽ���ֵʱ�����������������ƣ��������䣬��˵����Һ�л�����NH4+ �� ������Һ�����Կ�֪����Һ��һ������������SO42������һ�����У�H+��NH4+��Mg2+��Al3+��SO42�� �� һ������CO32����NO3����Fe3+ �� ��1����Һ��һ�����е���������H+��NH4+��Mg2+��Al3+�� һ�������е�������CO32����NO3����Fe3+��
���Դ��ǣ�H+��NH4+��Mg2+��Al3+��CO32����NO3����Fe3+����2��C��D�ķ�ӦΪ�������������������ƣ������ӷ���ʽΪAl��OH��3+OH��=AlO2��+2H2O��
���Դ��ǣ�Al��OH��3+OH��=AlO2��+2H2O����3������ͼ���֪��A��BΪMg2+��Al3+���������Ʒ�Ӧ��������������Ϊ0.5mol��0.1mol=0.4mol��
C��D��Ϊ���������ܽ�����������Al��OH��3+OH��=AlO2��+2H2O��������������0.8mol��0.7mol=0.1mol����n[Al��OH��3]=0.1mol��������Ԫ���غ��֪n��Al3+��=0.1mol��
��c��Al3+��= ![]() =1mol/L��
=1mol/L��
��þ���ӷ�Ӧ����������Ϊ0.4mol��0.1mol��3=0.1mol����n[Mg��OH��2]=0.05mol��
����c��Mg2+��= ![]() =0.5mol/L��
=0.5mol/L��
���Դ��ǣ�1��0.5��

 ������ĩ��ϰ��ѵ��ϵ�д�
������ĩ��ϰ��ѵ��ϵ�д� С��ʿ��ĩ����100��ϵ�д�
С��ʿ��ĩ����100��ϵ�д�