题目内容
7.对于反应2SO2+O2?2SO3达化学平衡状态后,下列说法正确的是( )| A. | 改变某一条件,使v(正)、v(逆)均改变,化学平衡一定移动 | |
| B. | 改变某一条件,使v′(正)>v′(逆)不变,化学平衡一定逆向移动 | |
| C. | 改变某一条件,使v′(正)增大,v′(逆)不变,化学平衡一定正向移动 | |
| D. | 改变某一条件后,v′(正)、v′(逆)同时增大或同时减小时,化学平衡不移动 |
分析 A.改变条件时,正逆反应速率改变且相等时平衡不移动;
B.改变条件时,如果使v′(正)>v′(逆)不变,则平衡正向移动;
C.改变条件时,使v′(正)增大,v′(逆)不变,则v′(正)>v′(逆),平衡正向移动;
D.改变条件时,v′(正)、v′(逆)同时增大或同时减小时,但二者不相等,平衡移动.
解答 解:A.改变条件时,正逆反应速率改变且相等时平衡不移动,如加入催化剂时同等程度的增大正逆反应速率,平衡不移动,故A错误;
B.改变条件时,如果使v′(正)>v′(逆)不变,则平衡正向移动,故B错误;
C.改变条件时,使v′(正)增大,v′(逆)不变,导致v′(正)>v′(逆),正反应速率大于逆反应速率而使平衡正向移动,故C正确;
D.改变条件时,v′(正)、v′(逆)同时增大或同时减小时,但二者不相等,平衡移动,如果正逆反应速率相等则平衡不移动,故D错误;
故选C.
点评 本题考查化学反应速率及化学平衡影响因素,为高频考点,改变条件时要根据正逆反应速率是否相等判断平衡是否移动及移动方向,题目难度不大.

练习册系列答案
 一诺书业暑假作业快乐假期云南美术出版社系列答案
一诺书业暑假作业快乐假期云南美术出版社系列答案
相关题目
2.下列叙述正确的是( )
| A. | 0.1mol•L-1氨水中,c(OH-)=c(NH4+) | |
| B. | 10 mL 0.02mol•L-1HCl溶液与10 mL 0.02mol•L-1Ba(OH)2溶液充分混合,若混合后溶液的体积为20 mL,则溶液的pH=12 | |
| C. | 在0.1mol•L-1CH3COONa溶液中,c(OH-)=c(CH3COOH)+c(H+) | |
| D. | 0.1mol•L-1某二元弱酸强碱盐NaHA溶液中,c(Na+)=2c(A2-)+c(HA-)+c(H2A) |
12.实验室为监测空气中汞蒸气的含量,通常悬挂有CuI的滤纸,根据滤纸是否变色或颜色发生变化的时间来判断空气中汞的含量,其反应为:4CuI+Hg=Cu2HgI4+2Cu.下列有关说法正确的是( )
| A. | 上述反应的产物Cu2HgI4中,Hg的化合价为+2 | |
| B. | 上述反应中CuI既是氧化剂,又是还原剂 | |
| C. | 上述反应中Hg元素与Cu元素均被氧化 | |
| D. | 上述反应中生成 64gCu时,转移的电子数为2NA |
19.在120℃条件下,1mL气态混合物与10mLO2混合后点燃,最终测得气体的总体积为11mL.则该气态混合物可能是( )
| A. | C2H4、C6H6 | B. | CH4、CH2O | C. | C2H6、CH3CHO | D. | C3H8、CH3CH2OH |
17.分类法在化学学科发展中起到了非常重要的作用,下列分类依据不合理的是( )
| A. | 根据氧化物的性质将氧化物分成酸性氧化物、碱性氧化物和两性氧化物等 | |
| B. | 根据反应中是否有电子转移将化学反应分为氧化还原反应和非氧化还原反应 | |
| C. | 根据是否有丁达尔现象将分散系分为溶液、胶体和浊液 | |
| D. | 根据组成元素的种类将纯净物分为单质和化合物 |
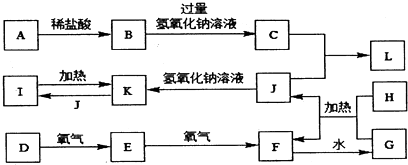
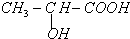 现以A为主要原料合成乙酸乙酯,其合成路线如图所示.
现以A为主要原料合成乙酸乙酯,其合成路线如图所示.
 A结构式CH2=CH2
A结构式CH2=CH2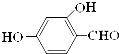 原儿茶醛是制造医药及染料的中间体,可用于制造多种抗菌素和消炎药物.其结构如图:请回答:
原儿茶醛是制造医药及染料的中间体,可用于制造多种抗菌素和消炎药物.其结构如图:请回答: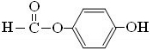 .
.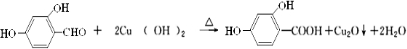 .
.