题目内容
有两种气体单质Am和Bn,已知2.4克Am和2.1克Bn所含有的原子个数相同,分子个数比为2:3;又知A和B的原子核内质子数都等于中子数,且A原子中的L层电子数是其K层电子数的3倍,则A元素的元素符号为________,B元素的元素符号为_________,m=_________;A和B形成红棕色化合物化学式为_________。
O, N, 3, NO2
试题分析:A原子中的L层电子数是其K层电子数的3倍,所以A是氧元素
2.4克Am和2.1克Bn所含有的原子个数相同
则

解得
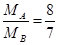
所以MB=14
由于B的原子核内质子数都等于中子数
所以B是氮元素,二者的形成的红棕色化合物是NO2
又因为分子个数比为2:3
所以

则m:n=3:2
因为n=2
所以m=3
点评:该题是基础性试题的考查,难度不大。试题设计新颖,基础性强,注重答题的灵活性,有利于培养学生的规范答题能力,提升学生的学科素养。该题的突破点是A元素的判断。

练习册系列答案
相关题目
 +
+ 

 +
+ 
 Rn,从而对人体产生伤害该同位素原子的中子数和质子数之差是( )
Rn,从而对人体产生伤害该同位素原子的中子数和质子数之差是( )