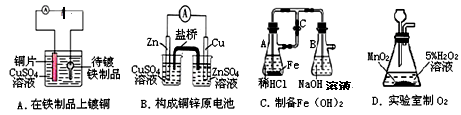
题目内容
下列说法正确的是 ( )
| A.电解饱和食盐水时,阳极的电极反应式为:2Cl- -2e-= Cl2 ↑ |
| B.氢氧燃料电池的负极反应式:O2 + 2H2O+ 4e- ="=" 4OH- |
| C.粗铜精炼时,与电源正极相连的是纯铜 |
| D.钢铁发生电化腐蚀的正极反应式:Fe-2e- ="=" Fe2+ |
A
解析试题分析:A.电解饱和食盐水时,由于阴离子的放电能力:Cl-> OH-,所以在阳极的电极反应式为:2Cl- -2e-= Cl2 ↑。正确。B.氢氧燃料电池的正极反应式:O2 + 2H2O+ 4e- ="=" 4OH-。错误。C.粗铜精炼时,与电源正极相连的是粗铜,与电源的负极相连的是纯铜。错误。D.钢铁发生电化腐蚀的负极反应式:Fe-2e- =Fe2+。错误。
考点:考查电化学反应原理及应用的知识。

练习册系列答案
 小学生10分钟口算测试100分系列答案
小学生10分钟口算测试100分系列答案
相关题目
以Fe为阳极,Pt为阴极,对足量的 Na2SO4 溶液进行电解,一段时间后得到4 mol Fe(OH)3沉淀,此间共消耗水的物质的量为 ( )
| A.6mol | B.8mol | C.10mol | D.12mol |
LiFePO4新型锂离子动力电池以其独特的优势成为奥运会绿色能的新宠。已知该电池放电时的电极反应式为:正极 FePO4+Li++e-==LiFePO4 负极 Li-e-="=" Li+下列说法中正确的是
| A.充电时电池反应为FePO4+Li = LiFePO4 |
| B.充电时动力电池上标注“+”的电极应与外接电的正极相连 |
| C.放电时电池内部Li+向负极移动 |
| D.放电时,在正极上是Li+得电子被还原 |
下列叙述中正确的是
| A.图①中正极附近溶液pH降低 |
| B.图①中电子由Zn流向Cu,盐桥中的Cl—移向CuSO4溶液 |
C.图②正极反应是O2+2H2O+4e¯ 4OH¯ 4OH¯ |
| D.图②中加入少量K3[Fe(CN)6]溶液,有蓝色沉淀生成 |
以葡萄糖为燃料的微生物燃料电池结构如右图所示。a为电池的正极,关于该电池的叙述正确的是
| A.该电池能够在高温下工作 | B.b电极发生还原反应 |
| C.O2在a电极被氧化 | D.电流从a电极经用电器流向b电极 |
下图是将SO2转化为重要的化工原料H2SO4的原理示意图,下列说法不正确的是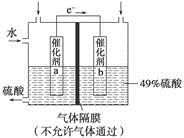
| A.该装置将化学能转化为电能 |
| B.催化剂b表面O2发生还原反应,其附近酸性增强 |
| C.催化剂a表面的反应是SO2+2H2O-2e-===SO42-+4H+ |
| D.若得到的硫酸浓度仍为49%,则理论上参加反应的SO2与加入的H2O的质量比为8∶15 |
某合作学习小组的同学利用下列氧化还原反应设计原电池:2KMnO4+10FeSO4+8H2SO4==2MnSO4+5Fe2(SO4)3+K2SO4+8H2O盐桥中装有饱和K2SO4溶液,下列叙述中正确的是
| A.乙烧杯中发生还原反应 |
| B.甲烧杯中溶液的pH逐渐减小 |
| C.电池工作时,盐桥中的SO42-移向甲烧杯 |
| D.外电路的电流方向是从a到b |
下列有关电池的说法不正确的是
| A.手机上用的锂离子电池属于二次电池 |
| B.铜锌原电池工作时,电子沿外电路从铜电极流向锌电极 |
| C.甲醇燃料电池可把化学能转化为电能 |
| D.锌锰干电池中,锌电极是负极 |