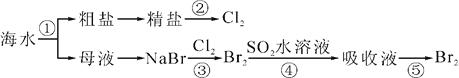
题目内容
【题目】某厂的酸性工业废水中含有一定量的Fe3+、Cu2+、Au3+等离子。有人设计了图中的工艺流程,从废水中回收金,并生产一定量的绿矾和胆矾。
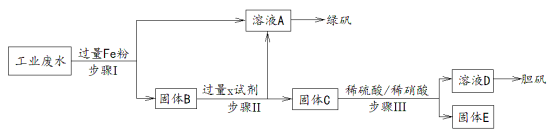
(1)试剂X是 ,固体C的成份是
(2)步骤I,II,III均需要进行的操作是
(3)写出步骤III处发生反应的离子方程式 ,稀硝酸在此反应中的作用是 , 将此过程收集到的NO与O2混合得16mL混合气体充满试管后倒扣水中,恢复原状况剩余气体为2mL,则原混合气体中NO的体积是 。
(4)制备胆矾方法有三种:①铜与混酸(稀硫酸和稀硝酸)的反应②铜与浓硫酸的反应③铜与稀硫酸和氧气的反应.请选出你认为的最佳方法,写出此方法的反应化学方程式 .
【答案】(1)稀硫酸;铜和金;
(2)过滤、洗涤
(3)3Cu+8H++NO3-=3Cu2++2NO↑+4H2O; 氧化性(剂);10mL或8mL
(4)2Cu+O2+2H2SO4=2CuSO4+2H2O
【解析】
试题分析:由工艺流程图示知,溶液A为亚铁元素的离子,固体B为铜、金的单质,通过过滤将铁元素与活泼性比它弱的铜、金分离出来,发生的反应为Fe + 2H + ═ Fe2 + + H2↑,2Fe3 + + Fe ═ 3Fe2 + ,Cu2 + + Fe ═ Cu + Fe2 + ,2Au3 + + 3Fe═2Au + 3Fe2 + ;步骤Ⅱ处加入稀硫酸以除去铜、金中过量的铁屑,并将过滤后的硫酸亚铁溶液与含Fe2 + 的A溶液相混合;Ⅲ处利用金不溶于硝酸的性质将铜与金分离开,固体E为金;溶液D为硫酸铜。
(1)根据上述分析,试剂X稀硫酸,固体C是铜和金,故答案为:稀硫酸;铜和金;
(2)步骤I,II,III均失分离固体和溶液,均需要采取过滤并洗涤的方法,故答案为:过滤、洗涤;
(3)步骤III处发生反应的离子方程式为3Cu+8H++NO3-=3Cu2++2NO↑+4H2O,其中稀硝酸是氧化剂,将NO与O2混合得16mL混合气体充满试管后倒扣水中,发生的反应为:4NO+3O2+2H2O=4HNO3,若剩余的2mL为NO时,则发生反应的NO和O2的总体积为:16mL-2mL=14mL,其中反应消耗NO为:14mL×![]() =8mL,则原混合气体中含有NO体积为:8mL+2mL=10mL;若剩余的6mL为氧气时,则发生反应的NO和O2的总体积为:16mL-2mL=14mL,其中反应消耗NO为:14mL×
=8mL,则原混合气体中含有NO体积为:8mL+2mL=10mL;若剩余的6mL为氧气时,则发生反应的NO和O2的总体积为:16mL-2mL=14mL,其中反应消耗NO为:14mL×![]() =8mL,故答案为:3Cu+8H++NO3-=3Cu2++2NO↑+4H2O; 氧化性(剂);10mL或8mL;
=8mL,故答案为:3Cu+8H++NO3-=3Cu2++2NO↑+4H2O; 氧化性(剂);10mL或8mL;
(4) ①铜与混酸(稀硫酸和稀硝酸)的反应,生成一氧化氮气体会污染空气;②铜与浓硫酸的反应生成二氧化硫气体会污染空气;③铜与稀硫酸和氧气的反应,反应的方程式为2Cu+O2+2H2SO4=2CuSO4+2H2O,不会污染空气,因此方法③最佳,故答案为:2Cu+O2+2H2SO4=2CuSO4+2H2O。