题目内容
【题目】已知H2(g)、CO(g)和CH3OH(l)的燃烧热△H分别为-285.8kJ·mol-1、-283.0kJ·mol-1和-726.5kJ·mol-1。请回答下列问题:
(1)用太阳能分解10mol水_____(填“吸收”或“放出”)的能量是________kJ;
(2)甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式为___________________;
(3)在2L的密闭容器中,合成甲醇反应:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g),在其他条件不变的情况下,考察温度对反应的影响,实验结果如下图所示(注:T1、T2均大于300℃);
CH3OH(g)+H2O(g),在其他条件不变的情况下,考察温度对反应的影响,实验结果如下图所示(注:T1、T2均大于300℃);
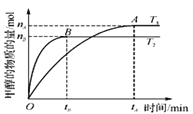
(A、B曲线分别对应T1、T2)
①T1_____T2(填“>”或“ <”)。
②该反应为_____热反应。
③该反应在T1时的平衡常数比T2时的____(填“大”或“小”)。
④处于A点的反应体系从T1变到T2,达到平衡时n(H2)/n(CH3OH)_____。
⑤在T1温度时,将1molCO2和3molH2充入一密闭恒容器中,充分反应达到平衡后,若CO2转化率为a,则容器内的压强与起始压强之比为_________。
【答案】 吸收 2858 CH3OH(l) +O2(g)=CO(g)+2 H2O(l) △H=-443.5kJ·mol-1 < 放 大 增大 1-a/2
【解析】(1)本题考查考查反应热,水的分解是吸热反应,因此分解10mol水需要吸收能量,根据信息氢气的燃烧热,消耗1molH2,即生成生成1mol水时放出的热量为285.8kJ,因此分解10molH2O时吸收的能量是10×285.8kJ=2858kJ;(2)考查热化学反应方程式的书写,①CO燃烧热的热化学反应方程式:CO(g)+1/2O2(g)=CO2(g) △H=-283.0kJ·mol-1,②CH3OH燃烧热的热化学反应方程式:CH3OH(l)+3/2O2(g)=CO2(g)+2H2O(l) △H=-726.5kJ·mol-1, 甲醇不完全燃烧生成液态水的化学反应方程式为:CH3OH+O2=CO+2H2O,②-①得出△H=(-726.5+283.0)kJ·mol-1=-443.5kJ·mol-1,CH3OH(l)+O2(g)=CO(g)+2H2O(l) △H=-443.5kJ·mol-1;(3)考查勒夏特列原理、化学平衡的计算,①T2先达到平衡平衡,说明T2温度下的反应速率快,即T2>T1;②根据图像,温度越高,甲醇的物质的量越低,根据勒夏特列原理,正反应是放热反应;③此反应是放热反应,且T2>T1,因此T1的平衡常数比T2的平衡常数大;④T1到T2甲醇的物质的量降低,升高温度,平衡向逆反应方向进行,氢气的量增大,此比值增大; ⑤根据CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g),反应后气体物质的量减少2mol,因此消耗1×amolCO2,物质的量减少2amol,即反应后气体物质的量为(4-2a)mol,同条件下,压强之比等于物质的量之比,即(4-2a):4=(2-a)/2。
CH3OH(g)+H2O(g),反应后气体物质的量减少2mol,因此消耗1×amolCO2,物质的量减少2amol,即反应后气体物质的量为(4-2a)mol,同条件下,压强之比等于物质的量之比,即(4-2a):4=(2-a)/2。

 通城学典默写能手系列答案
通城学典默写能手系列答案 金牌教辅培优优选卷期末冲刺100分系列答案
金牌教辅培优优选卷期末冲刺100分系列答案【题目】常温下,将某一元酸HA和NaOH溶液等体积混合,实验信息如下:
实验编号 | c(HA)/mo1·L-1 | c(NaOH)/mo1·L-1 | 反应后溶液pH |
甲 | 0.1 | 0.1 | pH=9 |
乙 | c1 | 0.2 | pH=7 |
下列判断不正确的是
A. 0.1 mo1·L-1的HA溶液中由水电离出的c(H+)=1×l0-13mo1/L
B. c1一定大于0.2 mo1·L-1
C. 甲反应后的溶液中:HA占含A微粒总数的0.02%
D. 乙反应后的溶液中:c(Na+)<c(HA)+c(A一)